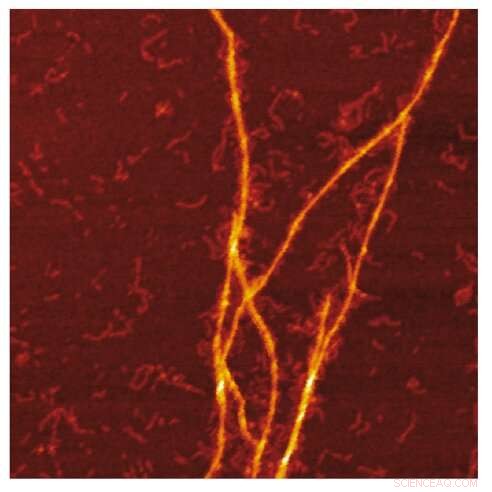
Imagem AFM do molde amilóide de fibrilas S100A9 na superfície de fibrilas Aβ. Crédito:Jonathan Pansieri
Uma equipe de pesquisa liderada por Ludmilla Morozova Roche na Universidade de Umeå, Suécia, forneceu uma visão mecanicista da coagregação de proteínas na doença de Alzheimer. O mecanismo de modelagem de amiloides S100A9 em superfícies fibrilares Aβ durante o processo de co-agregação foi revelado por sinergia de métodos biofísicos, incluindo espectrometria de massa de detecção de carga, microscopia, análises cinéticas e microfluídicas.
A formação de amilóide é de grande significado clínico, uma vez que este processo está envolvido em várias doenças neurodegenerativas, como Alzheimer, Parkinson e outros. Essas doenças afetam milhões da população idosa em todo o mundo. Muitas vezes é difícil traçar a linha entre essas doenças ou elas podem ocorrer simultaneamente, que é conhecido como comorbidade da doença.
Embora o processo de formação de amiloide tenha sido estudado extensivamente, pouco se sabe sobre os mecanismos específicos de co-agregação de diferentes espécies amiloides juntas, subjacente à comorbidade das doenças. Na doença de Alzheimer, a cascata neuroinflamatória amilóide se manifesta na co-agregação de Aβ com a proteína S100A9 pró-inflamatória, que leva à montagem amiloide intracelular e extracelular, deposição de placas amilóides e toxicidade celular.
Decifrar as interações entre a proteína S100A9 pró-inflamatória e o peptídeo Aβ42 na doença de Alzheimer é fundamental, uma vez que a inflamação desempenha um papel central no início da doença. Aqui, os pesquisadores usam espectrometria de massa de detecção de carga (CDMS) inovadora junto com técnicas biofísicas para fornecer uma visão mecanicista do processo de co-agregação e diferenciar complexos amilóides em um nível de partícula única.
A combinação de distribuições de massa e carga de amiloides junto com a reconstrução das diferenças entre eles e a microscopia detalhada revela que a co-agregação envolve modelagem de fibrilas S100A9 na superfície de amiloides Aβ42. A análise cinética corrobora ainda que as superfícies disponíveis para a nucleação secundária Aβ42 são diminuídas devido ao revestimento por amilóides S100A9, enquanto a ligação de S100A9 a fibrilas Aβ42 é validada por um ensaio microfuídico.
Os pesquisadores demonstram que a sinergia entre CDMS, microscopia, análises cinéticas e microfuídicas abrem novas direções na pesquisa interdisciplinar.