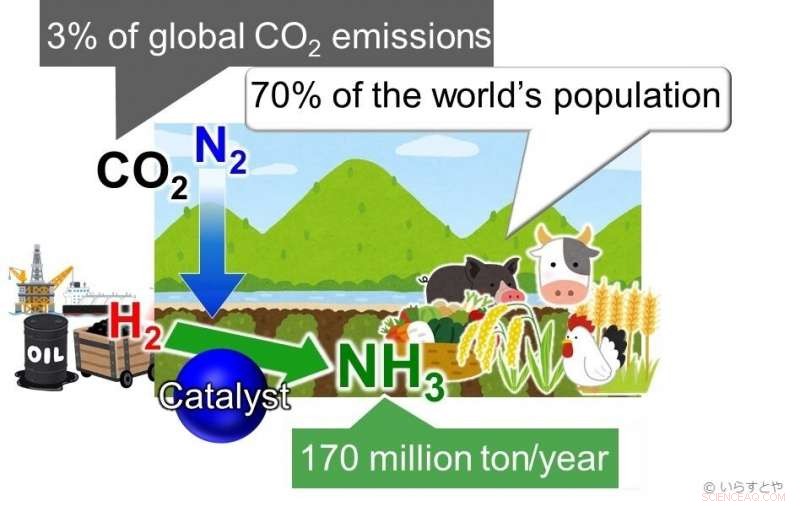
A amônia (NH3) é um dos produtos químicos industriais mais importantes hoje, sintetizado globalmente para uso em fertilizantes que permitem a produção de alimentos para aproximadamente 70% da população mundial. A amônia é atualmente obtida pela reação do nitrogênio (N2) do ar com o hidrogênio (H2). Esta reação requer alta energia e é, Portanto, alimentado por combustíveis fósseis, contribuindo para mais de 3% das emissões globais de CO2. Crédito:Irasutoya, Michikazu Hara
Cientistas do Instituto de Tecnologia de Tóquio (Tokyo Tech) desenvolveram um catalisador aprimorado tomando o agente desidratante comum, hidreto de cálcio, e adicionando flúor a ele. O catalisador facilita a síntese de amônia a apenas 50 ° C, usando apenas metade da energia que as técnicas existentes requerem. Isso abre portas para a produção de amônia com baixo consumo de energia e redução da emissão de gases de efeito estufa.
A amônia é fundamental para a produção de fertilizantes para plantas, que por sua vez alimenta aproximadamente 70% da população mundial. Na industria, a amônia é produzida através do processo Haber-Bosch, onde o metano é primeiro reagido com vapor para produzir hidrogênio, e o hidrogênio é então feito reagir com nitrogênio para dar amônia. O problema com este processo é que conforme a temperatura aumenta, o rendimento diminui. Para continuar a obter um bom rendimento, a pressão aplicada na câmara de reação precisa ser aumentada. Isso requer muita energia. Avançar, os catalisadores à base de ferro usados para a reação só são eficazes acima de 350 ° C. Manter essas altas temperaturas também requer uma quantidade significativa de energia. Para completar tudo, o rendimento é de apenas 30-40%.
Combustíveis fósseis são usados atualmente para alimentar o processo, contribuindo com grandes quantidades de dióxido de carbono para a atmosfera. Alternativas de recursos renováveis, como a energia eólica, Foram aplicados, mas esses não se mostraram sustentáveis. Para aumentar o rendimento e, ao mesmo tempo, reduzir os danos ao meio ambiente, Portanto, a reação deve ocorrer em baixas temperaturas. Para que isso aconteça, catalisadores que permitem a reação em baixas temperaturas são necessários.
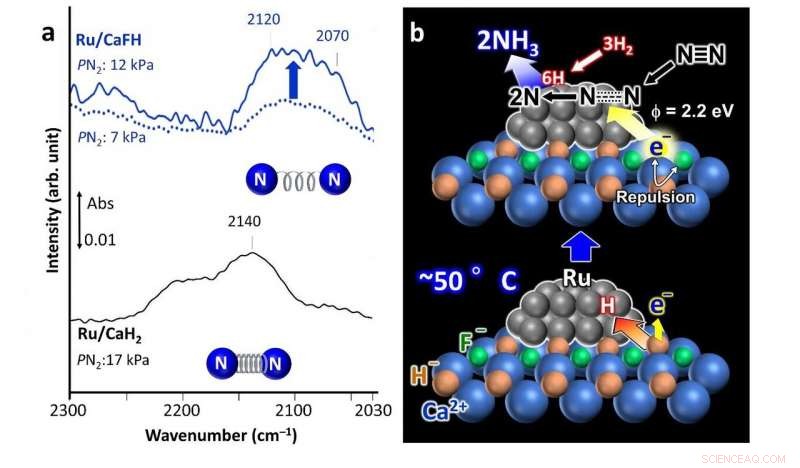
a) Espectro de infravermelho de forma de Fourier Trans (FT-IR) para adsorção de nitrogênio no catalisador Ru / CaFH contendo fluoreto desenvolvido (topo) mostrando ligação enfraquecida entre átomos de nitrogênio em comparação com um catalisador Ru / CaH2 não modificado (espectro inferior). b) Mecanismo de reação proposto usando o catalisador Ru / CaFH. Crédito: Nature Communications
Até aqui, tais catalisadores têm sido esquivos para os cientistas. "Os catalisadores convencionais perdem a atividade catalítica para a formação de amônia a partir do N 2 e H 2 gases a 100-200 ° C, mesmo que exibam alto desempenho catalítico em altas temperaturas, "comentou um grupo de cientistas da Tokyo Tech, Japão, que parecem ter finalmente resolvido o problema do catalisador. Os cientistas, liderado pelo Dr.Michikazu Hara, desenvolveu um catalisador que é eficaz mesmo a 50 ° C. "Nosso catalisador produz amônia a partir de N 2 e H 2 gases a 50 ° C com uma energia de ativação extremamente pequena de 20 kJmol -1 , que é menos da metade do relatado para catalisadores convencionais, "Dr. Hara e colegas relatam em seu artigo publicado em Nature Communications .
Seu catalisador compreende uma solução sólida de CaFH, com nanopartículas de rutênio (Ru) depositadas em sua superfície. A adição de flúor (F - ) para hidreto de cálcio (CaH 2 ), um agente desidratante comum, é o que torna o catalisador eficaz em temperaturas e pressões mais baixas. Depois de realizar análises espectroscópicas e computacionais, os cientistas propõem um possível mecanismo pelo qual o catalisador facilita a produção de amônia.
A ligação cálcio-fluoreto (Ca-F) é mais forte do que a ligação cálcio-hidrogênio (Ca-H). Então, a presença da ligação Ca-F enfraquece a ligação Ca-H e o Ru é capaz de extrair átomos de H do cristal do catalisador, deixando elétrons em seus lugares. Os átomos de H então são dessorvidos das nanopartículas de Ru como H 2 gás. Isso ocorre mesmo a 50 ° C. A repulsão de carga resultante entre os elétrons presos e F - íons no cristal diminuem as barreiras de energia para esses elétrons liberarem, dando ao material alta capacidade de doação de elétrons. Esses elétrons liberados atacam as ligações entre os átomos de nitrogênio no N 2 gás, facilitando a produção de amônia.
Este novo método de produção de amônia reduz as demandas de energia, reduzindo assim as emissões de dióxido de carbono do uso de grandes quantidades de combustíveis fósseis. Os resultados deste estudo iluminam a possibilidade de um processo Haber-Bosch ambientalmente sustentável, abrindo a porta para a próxima revolução na produção de alimentos agrícolas.