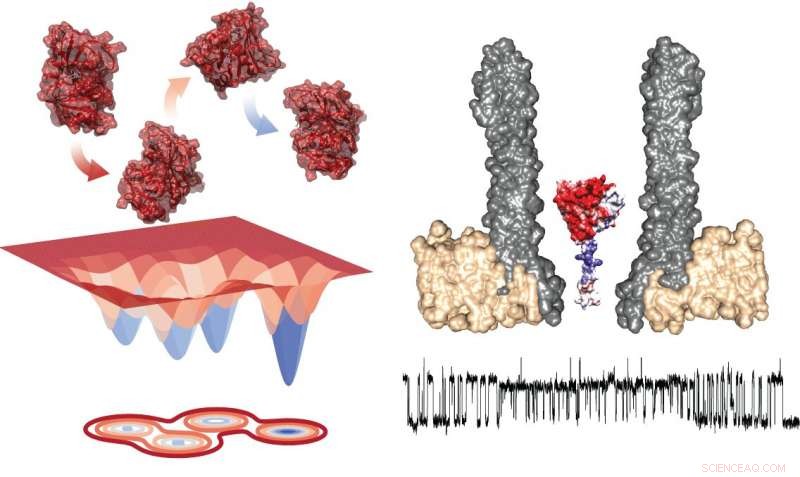
Diagrama de energia dos quatro conformadores (esquerda) e a configuração experimental mostrando o nanopore com a enzima aprisionada em seção transversal (direita). Por baixo, há um traço típico mostrando medições durante a troca dentro de rotâmeros. Crédito:Giovanni Maglia, Universidade de Groningen
Cientistas da Universidade de Groningen observaram as características de uma única enzima dentro de um nanoporo. Eles aprenderam que a enzima pode existir em quatro diferentes estados dobrados, ou conformadores, que desempenham um papel ativo no mecanismo de reação. Esses resultados terão consequências para a engenharia enzimática e o desenvolvimento de inibidores. O estudo foi publicado em Química da Natureza em 6 de abril.
As enzimas são proteínas dobradas que têm uma estrutura tridimensional específica que cria um sítio ativo que pode se ligar a um substrato e catalisar uma reação específica. Nos últimos anos, tornou-se claro que as enzimas não são estruturas rígidas, mas que as proteínas dobradas existem como um conjunto de conformações em equilíbrio em torno de um estado fundamental energeticamente estável.
Túnel de vento
O estudo da transição entre os estados requer a observação de enzimas individuais por um período prolongado de tempo, o que é desafiador. O professor associado de biologia química da Universidade de Groningen, Giovanni Maglia, desenvolveu nanoporos em forma de funil que podem capturar proteínas. Ao medir a corrente iônica através de tal nanopore embutido em uma membrana lipídica artificial, Maglia foi capaz de observar mudanças conformacionais em enzimas. "Você poderia comparar isso com estudar um carro em um túnel de vento, "ele explica." Abrir uma janela ou uma porta mudará o fluxo de ar. De maneira semelhante, uma mudança na estrutura de dobramento da enzima muda a corrente iônica através do poro. "
Maglia usou seu sistema nanopore para estudar a enzima dihidrofolato redutase (DHFR), que converte dihidrofolato em tetrahidrofolato. "Escolhemos esta enzima porque ela foi estudada como um sistema modelo para a dinâmica enzimática por mais de 30 anos, usando todas as técnicas disponíveis. Além disso, inibidores desta enzima, como metotrexato, são usados como drogas anticâncer.
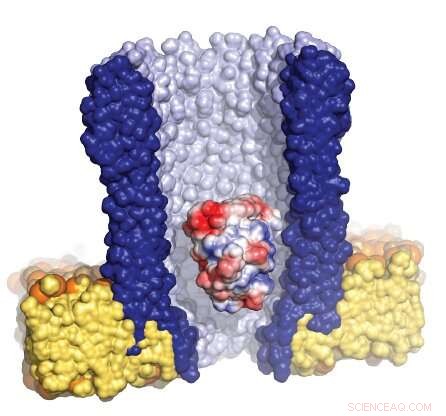
Ilustração do nanoporo em forma de funil (azul) cercado pela membrana artificial (amarelo), com uma única enzima (vermelha / branca / azul) presa dentro do poro. Crédito:Giovanni Maglia, Universidade de Groningen
Liberação eficiente
As medições de DHFR revelaram a presença de quatro conformadores com diferentes afinidades para os substratos. Maglia diz, "Alternar entre esses quatro estados foi muito lento. Isso significa que você só pode vê-los nesses tipos de estudos de longa duração com uma única enzima."
Adicionando o inibidor de reação metotrexato, que se liga à enzima, causou uma transição muito rápida entre os estados e alterou a afinidade das enzimas. “Nossa conclusão é que as reações da enzima com diferentes compostos fornecem energia livre para mudanças conformacionais, "diz Maglia.
Além disso, a mudança conformacional também mudou a afinidade das enzimas. Isso faz sentido, como a enzima precisa se ligar a dois substratos e, depois de completar a reação, deve liberar ambos. “O substrato e o produto são moléculas muito semelhantes, portanto, a enzima precisa mudar sua afinidade para uma liberação eficiente. "
Dois estados
Com base nesses estudos, Maglia pode ver a enzima alternando entre dois estados:Depois de ligar o substrato, NADPH impulsiona a reação, que então muda a conformação da enzima e, portanto, sua afinidade. Subseqüentemente, ligar um novo substrato o traz de volta ao primeiro estado. "Isso explica dois dos quatro conformadores que observamos; ainda não podemos dar sentido aos outros dois, "Maglia diz. É impossível derivar informações estruturais das medições.
No entanto, o estudo mostra o poder da tecnologia nanopore na determinação das mudanças estruturais das enzimas. "Também sabemos agora que esta enzima tem quatro estados básicos diferentes e deve alternar entre eles para funcionar." Isso adiciona um desafio ao projeto da enzima:isso não deve apenas produzir um centro reativo, mas também deve permitir as mudanças conformacionais necessárias. Maglia:"Isso pode explicar por que as enzimas projetadas artificialmente muitas vezes não funcionam tão eficientemente quanto as enzimas naturais." Finalmente, o estudo também permitirá que os cientistas identifiquem novas drogas inibidoras que se ligam mais fortemente ao DHFR do que o metotrexato.