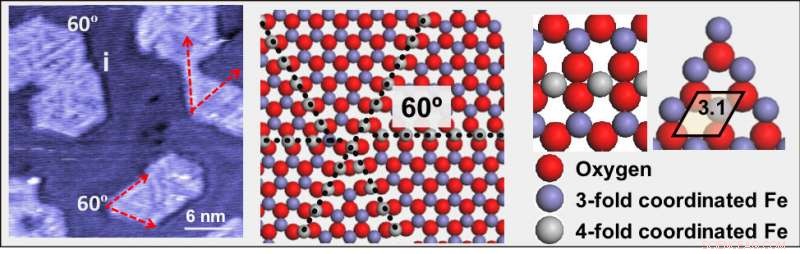
(Esquerda) Uma imagem de microscópio de tunelamento de varredura à pressão ambiente de óxido de ferro (FeO) em uma superfície de ouro. (Meio) Uma ilustração mostrando linhas de deslocamento feitas de átomos de ferro (cinza), rodeado por quatro átomos de oxigênio (vermelho). (À direita) Um modelo ampliado mostrando átomos de ferro coordenados por três (roxo) e quatro (cinza) átomos de oxigênio (vermelho). Crédito:Laboratório Nacional de Brookhaven
Catalisadores, ou substâncias que aceleram reações químicas, têm várias aplicações industriais. Um catalisador amplamente utilizado em conversores catalíticos é o paládio, que ajuda a transformar monóxido de carbono e hidrocarbonetos tóxicos do escapamento de veículos em dióxido de carbono e água por meio da oxidação. Mas, como outros metais preciosos, como a platina, o paládio é raro. Por causa de seu suprimento limitado, o paládio é uma mercadoria cara.
Substituir catalisadores de metais preciosos por aqueles baseados em metais mais abundantes, como o ferro, diminuiria significativamente seu custo. Contudo, catalisadores de ferro, embora altamente eficiente, tendem a desativar rapidamente. Por exemplo, catalisadores de óxido de ferro tornam-se "envenenados" quando suas superfícies são cobertas por espécies de carbono formadas durante as reações com moléculas contendo carbono, como quando o monóxido de carbono se dissocia em carbono e oxigênio. O carbono depositado na superfície do catalisador bloqueia os locais ativos e evita que outras reações ocorram, assim, "envenenando" e, em última análise, desativando o catalisador.
"Uma forma de óxido de ferro, FeO, é um material muito barato que é ativo para oxidação, mas muito ativo para seu próprio bem, "disse Dario Stacchiola, líder do Grupo de Ciência de Interface e Catálise no Center for Functional Nanomaterials (CFN) - um Departamento de Energia dos EUA (DOE) Office of Science User Facility no Brookhaven National Laboratory - e um professor adjunto no Departamento de Química da Stony Brook University. "Criar estruturas com ferro que sejam ativas o suficiente para promover a reação sem serem desativadas pode abrir a porta para o uso desses catalisadores em aplicações práticas."
Stacchiola e colaboradores encontraram uma estrutura que pode ser capaz de fazer exatamente isso. Os cientistas prepararam uma fina camada de nanopartículas de FeO no topo de uma superfície de ouro e descobriram que as linhas de deslocamento que aparecem na superfície de FeO são muito ativas, mas não são envenenadas. Essas linhas de defeito consistem em átomos de ferro rodeados por quatro átomos de oxigênio em vez dos três normais.
A equipe detectou os defeitos em imagens de alta resolução registradas por microscopia de tunelamento de varredura de baixa temperatura (STM) no CFN Proximal Probes Facility e na Universidade de Ciência e Tecnologia de Nanjing, na China, onde o membro da equipe e ex-pós-doutorado do CFN Tianchao Niu é agora professor. Em STM, a corrente elétrica é medida como um túnel de elétrons entre uma superfície de amostra e uma ponta de metal que varre a superfície.
Os cientistas então estudaram a oxidação e redução de FeO em ambientes de gás oxigênio e monóxido de carbono, respectivamente. Para monitorar a estrutura atômica e química do catalisador, eles realizaram estudos de ciências de superfície em temperatura ambiente e pressão ambiente (AP). Em particular, eles usaram um instrumento AP-STM de última geração disponível para usuários acadêmicos e industriais no CFN.
"Queríamos ver se o catalisador seria ativo em condições moderadas porque altas temperaturas ou pressões podem dissociar o monóxido de carbono em carbono, desativando o catalisador, "disse Stacchiola." Ao conduzir esses estudos à pressão ambiente, podemos observar como o material muda enquanto trabalha. Só então podemos entender os processos químicos que acontecem nos níveis atômico e molecular. "
Após a oxidação, as linhas de deslocamento desapareceram e a altura da camada de FeO aumentou, sugerindo que átomos de oxigênio foram incorporados. Uma exposição sequencial ao monóxido de carbono resultou na regeneração das linhas de deslocamento e uma redução na altura de FeO, indicando a remoção dos átomos de oxigênio. Depois de obter imagens de cada uma dessas etapas de reação por meio de AP-STM, os cientistas usaram a espectroscopia de fotoelétrons de raios-X (XPS) para determinar quais espécies químicas estavam presentes e seus respectivos estados de oxidação (número de elétrons removidos ou adicionados). Esta informação química pode ser determinada com base na energia dos elétrons emitidos da superfície da amostra após a excitação por raios-X.
"A oxidação e redução do FeO são reversíveis, "disse Stacchiola." O oxigênio foi adicionado e removido sem deixar carbono para trás. Como o ferro nas linhas de deslocamento é coordenado para um número diferente de átomos de oxigênio do que o normal, seu estado de oxidação muda. Essa mudança favorece a dissociação do oxigênio molecular - uma molécula muito estável - em dois átomos de oxigênio. O acúmulo de oxigênio atômico na superfície do FeO, por sua vez, promove a oxidação do monóxido de carbono. "
Zhao Jiang, da Universidade Xi'an Jiaotong, na China, calculou então a energética da via de reação. Jiang descobriu que a oxidação do monóxido de carbono é energeticamente mais fácil quando átomos de oxigênio adicionais são adsorvidos na superfície de FeO.
Daqui para frente, Stacchiola e seu grupo continuarão a explorar metais abundantes na terra para catálise. Ashley Head, um cientista do grupo, em colaboração com Baran Eren do Instituto Weizmann de Ciência em Israel, investigou recentemente o papel que as impurezas superficiais e o óxido de manganês desempenham no aumento catalítico de catalisadores de cobalto para a conversão de monóxido de carbono e hidrogênio em gás de síntese, que é usado na fabricação de produtos químicos e combustíveis. Esta experiência foi uma das primeiras totalmente conduzidas com o instrumento AP-XPS no CFN Proximal Probes Facility.
"As instalações complementares de microscopia e espectroscopia in situ abertas aos usuários do CFN são ideais para esses tipos de estudos de química de superfície, "disse Stacchiola.