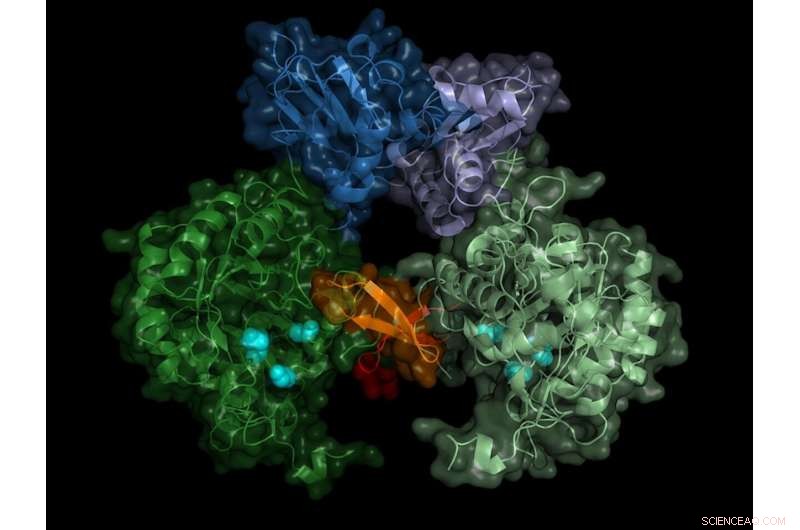
Estrutura da IMP desidrogenase do parasita. A enzima ativa forma pares (dímeros), a região "switch" (região de Bateman) é mostrada em tons de azul. Crédito:University of Lübeck / DESY, Lars Redecke
Usando flashes de raios-X ultrabrilhantes, uma equipe de pesquisadores rastreou um alvo potencial para novos medicamentos contra a doença do sono:os cientistas decodificaram a estrutura espacial detalhada de uma enzima vital do patógeno, o parasita Trypanosoma brucei. O resultado fornece um possível esquema para uma droga que bloqueia especificamente essa enzima e, portanto, mata o parasita, como a equipe liderada por Christian Betzel da Universidade de Hamburgo, Lars Redecke da Universidade de Lübeck e DESY, e Henry Chapman dos relatórios do DESY no jornal Nature Communications .
A doença do sono (tripanossomíase africana) é uma doença tropical causada pelo parasita Trypanosoma brucei, que é transmitida pela picada da mosca tsé-tsé, que habitam grande parte da África tropical. No corpo, o parasita primeiro se multiplica sob a pele, no sangue e no sistema linfático e depois migra para o sistema nervoso central. Se não for tratado, a doença é quase sempre fatal. Graças a medidas de controle intensivas, o número de casos registrados caiu drasticamente nos últimos anos. No entanto, a doença do sono ainda é considerada uma das doenças tropicais mais significativas. De acordo com a Organização Mundial da Saúde, mais de 60 milhões de pessoas nas áreas rurais da África Subsaariana estão em risco. Guerra, o deslocamento e a migração podem causar o agravamento da doença.
Na busca de um possível ponto de partida para drogas contra o patógeno, os pesquisadores tinham como alvo uma enzima central do organismo unicelular, inosina-5'-monofosfato desidrogenase (IMPDH). “Esta enzima pertence ao inventário central de cada organismo e é um alvo interessante para drogas porque regula a concentração de dois nucleotídeos vitais na célula:difosfato de guanosina e trifosfato de guanosina, "diz Redecke." A célula precisa desses nucleotídeos para fornecer energia e construir estruturas maiores, como o genoma. Se você interromper este ciclo, a célula morre. "
A enzima tem uma espécie de botão liga / desliga que é ativado pelo acoplamento das próprias moléculas da célula. Uma abordagem promissora é bloquear essa mudança com uma molécula ajustada com precisão. A fim de construir tal inibidor, a estrutura espacial exata do switch deve ser conhecida. Biólogos estruturais podem determinar a estrutura das biomoléculas usando raios-X. Para fazer isso, eles primeiro desenvolvem pequenos cristais das biomoléculas, que então geram padrões de difração característicos quando iluminados com raios-X. A partir desses padrões, a estrutura atômica do cristal e seus blocos de construção, as biomoléculas, pode ser calculado.
Esta abordagem é freqüentemente complicada pela intratabilidade da maioria das biomoléculas contra a formação de cristais. E se esses cristais podem crescer, geralmente são extremamente sensíveis aos raios X de alta energia e são rapidamente destruídos. "Embora as estruturas de numerosas desidrogenases IMP já sejam conhecidas, não houve sucesso no crescimento de cristais da versão Trypanosoma brucei da enzima, "relata Betzel, que também é pesquisador do Cluster of Excellence CUI:Advanced Imaging of Matter da University of Hamburg e do DESY.

A doença é transmitida pela mosca tsé-tsé. Crédito:CDC, Kay DeWitt (domínio público)
A equipe, portanto, escolheu um caminho alternativo:o grupo do co-autor Michael Duszenko, da Universidade de Tübingen, induziu certas células de insetos a cristalizar biomoléculas dentro delas. Usando essa chamada cristalização de celulo, a mesma equipe já havia decifrado outra enzima chave do patógeno da doença do sono, catepsina B, que também é um alvo potencial de drogas. Descobriu-se que as células alteradas do inseto também produzem cristais da desidrogenase agora investigada. Esses cristais formam pequenas agulhas com cerca de 5 milésimos de milímetro (5 micrômetros) de espessura e até 70 micrômetros de comprimento, de modo que eles se projetaram das células produtoras.
Os cristais in-cellulo são tão pequenos que raios X muito brilhantes são necessários para analisá-los. Quanto maior é um cristal, quanto mais átomos dentro dele podem espalhar raios-X, causando um melhor padrão de difração. Os pesquisadores, portanto, usaram o laser de raios-X LCLS no SLAC National Accelerator Laboratory nos EUA para a análise. "Os lasers de raios-X geram flashes extremamente intensos, "explica Chapman, que é um cientista líder no DESY no Center for Free-Electron Laser Science CFEL e um dos porta-vozes do Cluster of Excellence CUI:Advanced Imaging of Matter. "Embora os cristais sensíveis evaporem imediatamente, eles primeiro geram um padrão de difração a partir do qual a estrutura pode ser obtida. "O método usado aqui para explorar essas propriedades, chamada cristalografia serial de femtossegundo, foi desenvolvido anteriormente por muitos dos pesquisadores envolvidos neste estudo e eleito uma das dez maiores descobertas do ano pela revista Science em 2013.
A equipe registrou os padrões de difração de mais de 22, 000 microcristais e foi capaz de calcular a estrutura espacial da enzima com uma precisão de 0,28 milionésimos de milímetro (nanômetro) - isso corresponde aproximadamente ao diâmetro de um átomo de alumínio. "O resultado não mostra apenas a estrutura exata da chave enzimática, a região de Bateman, mas também quais moléculas da célula ativam a chave e como esses chamados cofatores se ligam à chave enzimática, "relata Karol Nass, que realizou este trabalho durante seus estudos de Ph.D. no DESY. Ele agora trabalha no Instituto Paul Scherrer na Suíça e é, junto com a Redecke, autor principal da publicação.
A troca é operada pelas moléculas de trifosfato de adenosina (ATP) e monofosfato de guanosina (GMP). “A vantagem do nosso método não é apenas podermos investigar a enzima à temperatura ambiente, em que a enzima opera naturalmente, mas também que durante a cristalização em celulo os cofatores naturais se ligam à enzima, "disse Betzel. De acordo com o pesquisador, os dados podem agora fornecer uma abordagem para inibir a IMP desidrogenase do parasita. "Pode-se pensar em construir uma espécie de fecho que cubra os locais de ligação de ambos os cofatores, por exemplo."
Contudo, um desafio restante é projetar o inibidor da desidrogenase IMP de uma forma específica que bloqueie a enzima do parasita, mas não a enzima humana. Se tiver sucesso, o método poderia ser potencialmente estendido a outros patógenos, explica Betzel. "Outros parasitas têm uma estrutura muito semelhante, e também pode ser possível atacar aqueles através da respectiva IMP desidrogenase. A enzima é um alvo muito interessante para drogas, por exemplo, contra a tênia da raposa ou o patógeno da elefantíase. "
As universidades de Hamburgo, Lübeck e Tübingen, a Academia Russa de Ciências, Arizona State University, o Laboratório Nacional Lawrence Livermore nos EUA, o Instituto Max Planck de Pesquisa Médica, o US National Accelerator Laboratory SLAC, a Universidade de Gotemburgo e o DESY estiveram envolvidos nesta pesquisa.