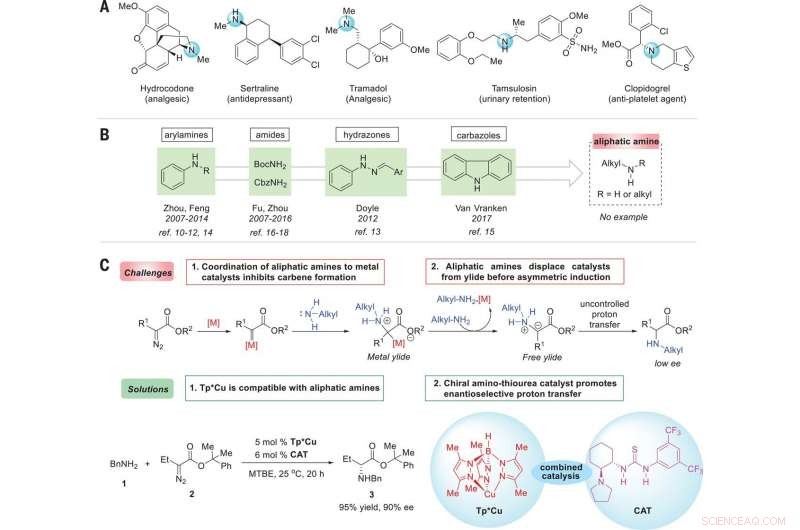
Estratégia para enantiocontrole de reações de inserção N – H de aminas alifáticas com carbenos. (A) Drogas representativas que demonstram a onipresença de aminas alifáticas quirais em moléculas bioativas. (B) Fontes de amina relatadas para reações de inserção N – H enantiosseletivas. (C) Reações de inserção de N – H catalisadas por metal de transição enantiosseletivo com aminas alifáticas:desafios e soluções. Condições ideais de reação:A reação de 1 (0,2 mmol), 2 (0,22 mmol), Tp * Cu (5% molar), e CAT (6% molar) foi realizado em 3 ml de éter metil terc-butílico (MTBE) a 25 ° C durante 20 horas. BnNH2, benzilamina; BocNH2, carbamato de terc-butilo; CbzNH2, carbamato de benzilo; Mim, metilo; Et, etilo; Ph, fenil; M, metal; ref., referência. Crédito: Ciência (2019). doi:10.1126 / science.aaw9939
Uma equipe de químicos da Universidade de Nankai desenvolveu uma abordagem em duas etapas para converter aminas alifáticas em aminoácidos não naturais. Em seu artigo publicado na revista Ciência , o grupo descreve sua abordagem, como funcionou bem, e aplicativos que podem se beneficiar de seu uso. John Ovian e Eric Jacobsen, da Harvard University, publicaram um artigo complementar na mesma edição do jornal, descrevendo alguns dos obstáculos para forjar laços com reagentes ricos em nitrogênio; também descreve a abordagem usada pela equipe na China.
Os pesquisadores começaram observando que as aminas quirais são usadas em uma ampla variedade de produtos naturais, e ressaltam que também são amplamente utilizados em agroquímicos e farmacêuticos. Eles observam que 43 por cento dos 200 medicamentos de prescrição mais prescritos em 2016 tinham pelo menos uma porção de amina analifática. Eles ainda observam que, por causa disso, desenvolver reações enantiosseletivas catalisadas por metal de transição que formam ligações C – N são de grande interesse nos círculos de química.
Como Ovian e Jacobsen observam, os químicos usam uma variedade de compostos que têm ligações carbono-nitrogênio em uma das duas orientações de imagem espelhada possíveis. Mas, como eles também apontam, fazer isso pode apresentar dificuldades devido à interação do nitrogênio com um determinado catalisador. Neste novo esforço, os pesquisadores descobriram uma maneira de contornar esse problema desenvolvendo uma abordagem em duas etapas para converter aminas alifáticas em aminoácidos não naturais. Em sua abordagem, eles aplicaram um catalisador de cobre para servir como meio de ativar um reagente de carbono - em seguida, adicionaram um catalisador de tioureia que fazia ligações de hidrogênio para produzir produtos de alta seletividade. Eles observam que o sucesso da transformação dependeu das propriedades únicas de ambos os catalisadores. Eles relatam ainda que a reação resultante deve funcionar igualmente bem com uma ampla gama de derivados diazo de parceiros de acoplamento éster / amina.
Ovian e Jacobsen observam ainda que o emparelhamento de uma amina com um carbenóide permitiu a estabilização por um grupo carboxila e forneceu uma boa maneira de criar derivados de α-aminoácidos não naturais. O método também traça um caminho para estender as inserções de carbenóides catalisados por metal em ligações N-H a aminas alifáticas e representa o potencial de desenvolvimento de novas transformações assimétricas.
© 2019 Science X Network