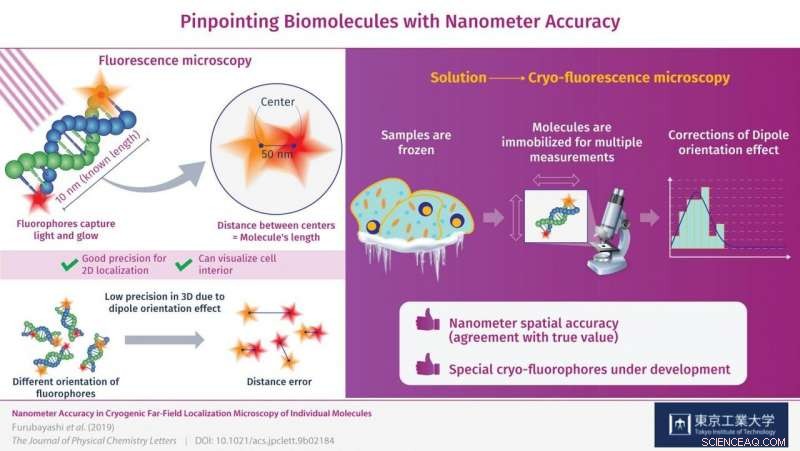
A precisão do nanômetro na microscopia de localização de fluorescência de campo distante de dois fluoróforos ligados a ambas as extremidades de 30 pares de bases de uma molécula de DNA de fita dupla (dsDNA) foi demonstrada usando microscopia de crio-fluorescência. Crédito:Tokyo Tech
Seria impossível compreender a vida sem ter um domínio firme sobre as interações microscópicas entre as moléculas que ocorrem dentro e ao redor das células. Os microscópios são e têm sido uma ferramenta inestimável para os pesquisadores nesse sentido, e existem muitos tipos diferentes de microscópios e técnicas de microscopia. De acordo, essas diferentes técnicas têm finalidades diferentes e têm vantagens e desvantagens.
Em biologia e medicina em particular, os pesquisadores estão buscando técnicas de microscopia para obter informações tridimensionais sobre o arranjo e a orientação de moléculas individuais dentro das células em escala nanométrica. Uma abordagem plausível para conseguir isso é criogênica (ou seja, em temperaturas extremamente baixas) tomografia eletrônica. Contudo, esta técnica não pode ser usada para observar o interior das células e é limitada a fatias finas extraídas da célula de amostra, o que não é tão útil quanto ser capaz de localizar moléculas diretamente dentro de células intactas.
Para obter medidas mais úteis, a luz visível pode ser usada para iluminar amostras especiais no que é conhecido como microscopia de fluorescência. Ao usar este método, as moléculas alvo são marcadas com "fluoróforos, "que são moléculas minúsculas que absorvem energia da luz de uma cor específica (frequência) e a reemitem brilhando. Embora essa abordagem tenha sido relatada como útil para localizar fluoróforos individuais no plano XY (uma superfície plana), a localização 3D significativa de biomoléculas requer mais precisão na direção Z, ou profundidade, do que o que é atualmente possível.
É por isso que uma equipe de pesquisadores da Tokyo Tech, incluindo o Dr. Satoru Fujiyoshi, A Universidade de Nagoya e a Universidade de Kyoto mergulharam fundo na microscopia de crio-fluorescência para obter uma visão das fontes de erro em tais medições e maneiras de corrigi-los. As amostras que usaram eram moléculas de DNA de comprimento conhecido (10 nanômetros) com diferentes fluoróforos em cada extremidade.
Inicialmente, após obter imagens de ambos os fluoróforos e determinar a distância entre eles para ver se correspondia ao comprimento das moléculas de DNA, houve um erro significativo em suas medições. Isso foi causado pela orientação do fluoróforo no espaço 3-D, que nem sempre estava perfeitamente alinhado com o plano de observação e, em vez disso, estava inclinado ou inclinado. Isso é conhecido como "efeito de orientação dipolo" e é um fator limitante grave na microscopia de fluorescência. O efeito está ligado à baixa precisão de medição na direção Z e, como os pesquisadores demonstraram, pode ser corrigido.
É aqui que entra em jogo a medição em condições criogênicas. As moléculas são congeladas instantaneamente no lugar, permitindo as medições 3-D de alta precisão que se opõem ao efeito de orientação do dipolo. A precisão (reprodutibilidade) com a qual os fluoróforos foram localizados foi de ± 1 nanômetro no plano de observação e ± 11 nanômetros na direção Z, ou profundidade, o que é inédito para este tipo de microscopia. Por meio dessas correções, os pesquisadores conseguiram localizar os fluoróforos nas moléculas de DNA com precisão nanométrica (de acordo com o valor real). "Ao corrigir o efeito de orientação do dipolo, conseguimos melhorar a precisão da localização desses fluoróforos até o nível nanométrico, "comenta o Dr. Fujiyoshi.
A equipe de pesquisa continuará seu trabalho nesta abordagem usando um par de fluoróforos projetados especificamente para condições criogênicas, com o qual esperam obter resultados ainda melhores. “Este tipo de microscopia de crio-fluorescência contribuirá para revelar os mecanismos e processos dentro das células a nível molecular, "diz o Dr. Fujiyoshi.