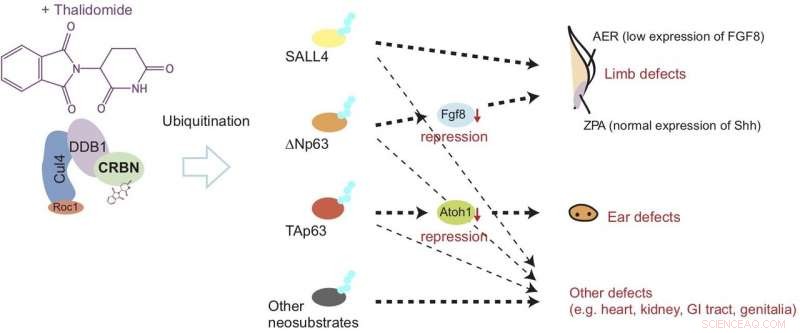
A talidomida se liga ao cereblon (CRBN) e causa o desenvolvimento anormal dos membros e da orelha, induzindo a quebra de proteínas chamadas? Np63α e TAp63α por meio de um processo conhecido como ubiquitinação. Este modelo sugere que os defeitos são desencadeados por regulação negativa de fatores de crescimento chamados Fgf8 e Atoh1. Crédito: Nature Chemical Biology
Pesquisadores no Japão e na Itália aprofundaram a compreensão da maneira como a talidomida causa anormalidades de desenvolvimento em nível molecular. Um estudo internacional com coautoria de pesquisadores do Instituto de Tecnologia de Tóquio (Tokyo Tech) e da Universidade Médica de Tóquio revelou uma visão detalhada de como a talidomida, uma das drogas mais notórias já desenvolvidas, causa anormalidades no desenvolvimento dos membros e da orelha. As descobertas podem contribuir para o ressurgimento de ou não teratogênico, drogas derivadas da talidomida como tratamento para câncer e doenças inflamatórias.
Originalmente usado no final da década de 1950 como tratamento para enjôos matinais, evidências no início dos anos 1960 ligavam a talidomida a anormalidades, incluindo membros encurtados e órgãos defeituosos, o que levou à sua proibição em todo o mundo. Notavelmente, com base em descobertas subsequentes que destacaram as propriedades antiinflamatórias e outras propriedades benéficas da talidomida, a droga se tornou um grande exemplo de uma que pode ser reaproveitada para tratar doenças como hanseníase e mieloma múltiplo, um tipo de câncer no sangue.
"A tragédia da talidomida não é um caso aberto e fechado na história médica, mas está em andamento, como novos bebês da talidomida nasceram após sua reaprovação por volta de 2000, "explica o bioquímico Yuki Yamaguchi, da Tokyo Tech." Mas agora sabemos que a talidomida e seus derivados são altamente eficazes e estão associados a poucos efeitos colaterais, exceto para os efeitos teratogênicos no feto, ao contrário de muitos outros agentes anticâncer convencionais. Portanto, a teratogenicidade continua sendo um grande obstáculo para uma aplicação mais ampla dessas drogas promissoras ”.
Para investigar os mecanismos por trás da atividade da talidomida em mais detalhes, Yamaguchi colaborou com Hiroshi Handa da Tokyo Medical University, Luisa Guerrini, da Universita degli Studi di Milano, Itália, e outros para conduzir estudos de desenvolvimento usando peixe-zebra como organismo modelo. Esta colaboração teve como objetivo explorar o palpite de Guerrini de que a família de proteínas p63 pode estar criticamente envolvida. Em 2010, uma equipe liderada por Handa e Yamaguchi alcançou um avanço ao identificar o cereblon como uma proteína-chave por meio da qual a talidomida inicia seus efeitos adversos ou teratogênicos.
Agora, o último estudo publicado em Nature Chemical Biology mostra que após a ligação ao cereblon, a talidomida causa danos às nadadeiras (correspondendo aos membros) e às vesículas óticas (correspondendo às orelhas), induzindo a quebra de dois tipos de proteína p63. Especificamente, o estudo sugere que a quebra de ΔNp63α resulta em defeitos nos membros, enquanto o de TAp63α leva a defeitos de ouvido, conforme mostrado na Figura 1.
Compreender como o cereblon funciona para mediar os efeitos da talidomida pode transformar a maneira como as drogas são desenvolvidas - afastando-se da descoberta fortuita em direção ao design molecular racional. "A mudança seria como deixar de procurar uma agulha em um palheiro para esculpir uma agulha em osso, "Notas Yamaguchi.
"É provável que veremos o desenvolvimento de novos medicamentos baseados na talidomida sem efeitos teratogênicos em um futuro próximo, " ele diz.