
Crédito:Elena Khavina / MIPT
Pesquisadores do Instituto de Física e Tecnologia de Moscou publicaram uma revisão sobre a cristalografia serial de femtossegundos, um dos métodos mais promissores para analisar a estrutura terciária de proteínas. Esta técnica evoluiu rapidamente na última década, abrindo novas perspectivas para o design racional de drogas visando proteínas anteriormente inacessíveis à análise estrutural. O artigo saiu na revista Opinião de especialista sobre descoberta de drogas .
Cristalografia de raio-x
A cristalografia de raios-X é um dos principais métodos para revelar a estrutura 3-D de macromoléculas biológicas, como proteínas. Ajudou a determinar a estrutura de numerosas enzimas e receptores farmacologicamente importantes, permitindo a concepção de drogas visando essas proteínas.
O método envolve cristalizar uma proteína e estudá-la por meio de difração de raios-X. Primeiro, a proteína é isolada e purificada. Em seguida, o solvente seca gradualmente. Como resultado, as moléculas cuja estrutura está sendo investigada formam cristais, caracterizado por uma ordem interna. Ao expor um cristal a raios-X em um dispositivo especial, os pesquisadores obtêm um padrão de difração. Ele contém informações sobre as posições dos átomos no cristal. Uma análise detalhada do padrão revela a estrutura 3-D das moléculas de proteína constituintes.
Antes do advento deste método, novos medicamentos foram procurados principalmente empiricamente:seja alterando a estrutura das moléculas conhecidas por afetar a proteína-alvo, ou classificando através de matrizes de moléculas em bibliotecas químicas. Agora que as estruturas 3-D de muitas proteínas-alvo estão disponíveis, os pesquisadores podem visualizá-los na tela do computador e rapidamente classificar milhões de compostos em busca de candidatos a medicamentos. Dessa forma, eles economizam muito tempo e dinheiro anteriormente gastos em síntese química e experimentos "úmidos".
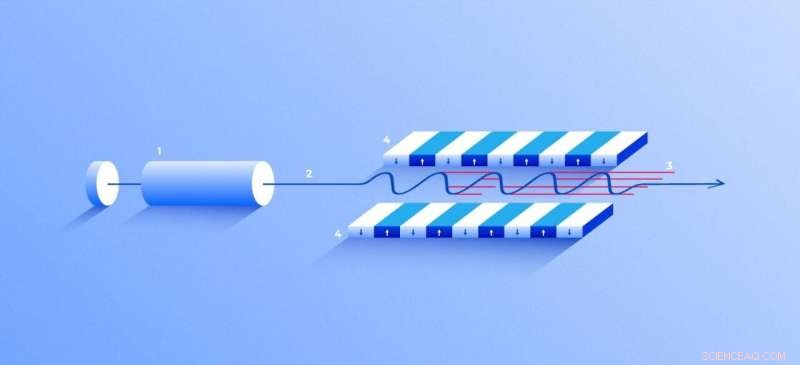
Laser de raios-X de elétrons livres. Uma fonte (1) emite elétrons livres (2) movendo-se apenas dezenas de vezes mais lento do que a velocidade da luz através do ondulador (4), um túnel forrado com muitos ímãs. O campo magnético faz com que um elétron viajando pelo túnel oscile e, portanto, emita raios-X. O movimento dos elétrons no ondulador é sincronizado para gerar tenso, pulsos de raios X de alta freqüência de notável intensidade (3). Crédito:Elena Khavina / MIPT
A cristalografia de raios-X produz bons resultados para cristais grandes, estábulo, e homogêneo, isto é, sem impurezas ou defeitos estruturais. Para detectar melhor um sinal de difração fraco, um poderoso pulso de radiação é necessário, mas não tão poderoso a ponto de destruir o cristal. Na cristalografia de raios-X convencional, um cristal de proteína é girado no feixe de raios-X para produzir padrões de difração para várias orientações espaciais. Isso captura o máximo de informações sobre a estrutura.
Método para alvos complicados
Logo após o surgimento da cristalografia de raios-X, tornou-se claro que nem todas as macromoléculas biológicas podem ser cristalizadas. Algumas proteínas são normalmente dissolvidas no meio interno da célula. Portanto, é bastante fácil colocá-los em solução, evapore-o, e obter um grande cristal regular. Mas proteínas de membrana, muitos receptores entre eles, formam cristais que não são grandes e puros o suficiente para a cristalografia de raios-X padrão. Dito isto, muitas dessas proteínas estão envolvidas no desenvolvimento de doenças, o que significa que sua estrutura é de grande interesse para os farmacologistas.
Menos de uma década atrás, uma solução foi encontrada para proteínas de membrana. Esta nova técnica, chamada de cristalografia de raios-X serial de femtosegundo, ou SFX, depende de lasers de elétrons livres de raios-X, desenvolvido pouco antes do SFX.
Alexey Mishin, vice-chefe do Laboratório de Biologia Estrutural de Receptores do MIPT, quem é co-autor do estudo, explicou:"O que o torna uma tecnologia inovadora é uma densidade de energia muito alta do pulso de laser. O objeto é exposto a uma radiação tão poderosa que se desfaz, inevitavelmente e quase instantaneamente. Mas antes que isso aconteça, alguns quanta individuais do pulso de laser se espalham pela amostra e acabam no detector. Este é o chamado princípio de difração antes da destruição para estudar a estrutura da proteína original. "

Duas maneiras de alimentar cristais na área de operação do dispositivo:em um fluxo de líquido (3, esquerda) e em um substrato sólido (3, direito). Em ambos os casos, o feixe de raios X (2) passando pelos cristais gera um padrão de difração na tela (1). Crédito:Elena Khavina / MIPT
Lasers de elétrons livres de raios-X provaram ser úteis fora da biologia:nos últimos anos, SFX tem sido usado cada vez mais frequentemente por físicos e químicos, também. O primeiro dispositivo foi disponibilizado para os experimentadores em 2009, e agora são cinco centros abertos a pesquisadores nos EUA, Japão, Coreia do Sul, Alemanha, e Suíça. Um novo está sendo construído na China, e as instalações dos EUA - historicamente a primeira - anunciou planos de modernização.
Embora a nova tecnologia tenha oferecido aos pesquisadores um vislumbre da estrutura das proteínas que antes escapavam à análise, também promoveu novas soluções técnicas e matemáticas. A cristalografia de raios-X convencional envolve a exposição de um cristal à radiação de vários ângulos e a análise coletiva dos padrões de difração resultantes. Em SFX, o cristal é instantaneamente destruído pela primeira interação com um poderoso pulso de raios-X. Portanto, os pesquisadores precisam repetir o processo com muitos cristais pequenos e analisar os dados "seriais" gerados, daí o nome do método.
Um outro desafio é selecionar as amostras para SFX. Na cristalografia de raios-X convencional, simplesmente escolher o cristal maior e da mais alta qualidade era o caminho a percorrer. Isso pode ser feito manualmente, olhando as amostras disponíveis. O novo procedimento requer trabalhar com uma suspensão de muitos pequenos cristais de vários tamanhos e qualidades. Centrífugas e filtros com dimensões de poros conhecidas são usados para separar os cristais por tamanho.
Métodos para colocar as amostras na câmara tiveram que ser elaborados, também. Os lasers de elétrons livres de raios X têm uma certa frequência máxima na qual podem emitir pulsos de radiação. Para reduzir as despesas e o consumo de tempo, novos cristais devem ser alimentados na câmara na mesma freqüência. Até aqui, duas abordagens foram desenvolvidas para fazer isso. Sob o primeiro, os cristais entram na câmara em uma suspensão líquida, fornecido por um injetor. O jato que sai do injetor é "espremido" por um fluxo de gás para garantir a colocação correta da amostra. Isso é, ao passar, um cristal termina precisamente no centro do feixe de laser (fig. 2, deixou). Alternativamente, os cristais de proteína podem ser espalhados sobre um substrato transparente aos raios X e alimentados automaticamente no feixe de laser antes de cada pulso (fig. 2, direito).
Desde a produção de seus primeiros resultados em 2011, SFX revelou mais de 200 estruturas de proteínas. Entre eles estão 51 alvos potencialmente importantes para a farmacologia - receptores de membrana, fermentos, proteínas virais, etc - que antes eram inacessíveis às técnicas analíticas convencionais.
A revisão sistemática da tecnologia aplicada à biologia e farmacologia pela equipe do MIPT, sem dúvida, ajudará outros pesquisadores que buscam obter as estruturas dos alvos-chave dos medicamentos para desenvolver novos medicamentos.