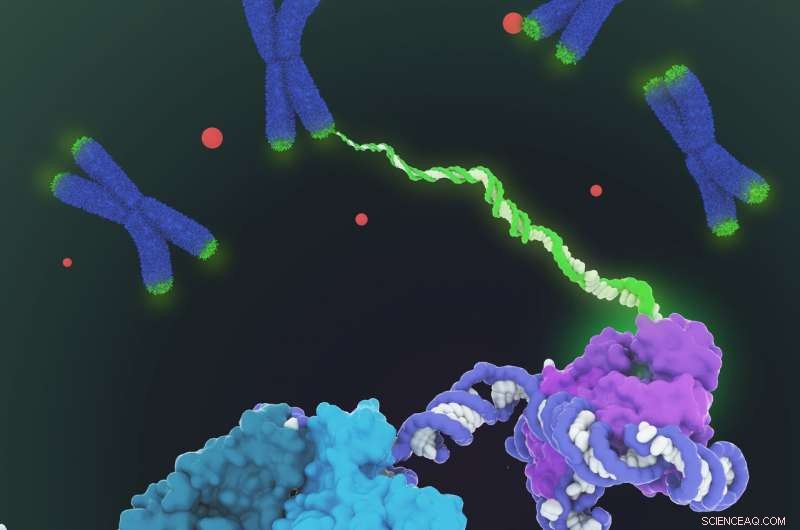
É mostrado o modelo de preenchimento de espaço da estrutura da holoenzima da telomerase humana determinada por microscopia crioeletrônica (crio-EM). A telomerase catalisa a síntese de DNA telomérico (verde) nas extremidades dos cromossomos (azul) para compensar a perda de telômeros durante a replicação do genoma. A estrutura compreende dois lóbulos com funcionalidades distintas:o núcleo catalítico (roxo) responsável pela síntese de DNA e um lóbulo de ribonucleoproteína H / ACA (ciano, verde-azulado e verde claro) importantes para a biogênese da telomerase e localização no corpo do Cajal (pontos vermelhos e parte inferior esquerda em close). Dado que a regulação da telomerase está implicada no câncer e no envelhecimento, esta primeira visualização arquitetônica da telomerase humana representa um avanço importante no campo da telomerase e no projeto terapêutico baseado na telomerase. Crédito:Janet Iwasa
Mais de 30 anos atrás, quando a Universidade da Califórnia, Os pesquisadores de Berkeley descobriram a telomerase - uma enzima que alonga as extremidades dos cromossomos e as impede de se desgastar o suficiente para matar uma célula - as especulações correram soltas sobre seu papel no envelhecimento e no câncer, desencadeando uma pressão em todo o tribunal para produzir drogas para ativar ou bloquear a enzima.
Embora nenhum dos medicamentos anti-envelhecimento à base de telomerase, tida como uma "fonte da juventude, "nem drogas anticâncer surgiram ainda, a publicação hoje por cientistas da UC Berkeley da primeira imagem detalhada da estrutura molecular da telomerase humana deve impulsionar esse esforço, permitindo triagens de drogas mais direcionadas e design inteligente de novas drogas.
"Já demorou muito para chegar. Foi preciso muita persistência, "disse Kathleen Collins, um professor de biologia molecular e celular da UC Berkeley que trabalhou na enzima por 26 anos.
Collins e Eva Nogales, também professor de biologia molecular e celular, são os autores seniores de um artigo que descreve a estrutura molecular 3-D da enzima telomerase humana publicado esta semana no jornal Natureza .
Um gargalo tem sido a obtenção de amostras puras desta molécula complexa, que é composto de uma estrutura de RNA decorada por seis tipos de proteínas que se movem à medida que adicionam DNA às extremidades dos cromossomos. Laboratórios de todo o mundo têm debatido se a enzima opera sozinha ou como gêmeos siameses, e como e quantas proteínas decoram a estrutura do RNA.
Sem consenso sobre essas questões, provou-se difícil projetar um medicamento para atingir a máquina molecular e destruir a atividade da telomerase - o que poderia interromper um câncer que aumentou seus níveis de telomerase - ou reiniciar a telomerase, talvez para preparar o corpo para uma rápida divisão celular após um transplante de medula óssea.
A estrutura recém-revelada ainda carece de detalhes finos, mas combinado com o conhecimento da sequência do gene da telomerase humana, fornece informações suficientes para começar a pensar sobre possíveis alvos para drogas, disse o primeiro autor Thi Hoang Duong "Kelly" Nguyen, um pós-doutorado do Miller Institute na UC Berkeley.
"As melhores imagens anteriores da telomerase humana tinham uma resolução de apenas 30 Ångstroms; fomos capazes de obter resolução de cerca de 7 a 8 Ångstroms usando microscopia crioeletrônica, "Kelly disse." Quando cheguei ao ponto em que podia ver todas as subunidades - tínhamos 11 subunidades de proteína no total - foi um momento de, 'Uau, Uau, é assim que todos eles se encaixam. '"
Nguyen, Collins e Nogales estão trabalhando ativamente para melhorar a resolução para 3 ou 4 Ångstroms - aproximadamente o tamanho de dois átomos de carbono - o que é suficiente para o projeto de drogas.
Telomerase completa os telômeros
Os telômeros foram detectados pela primeira vez em nível molecular no final dos anos 1970 por Elizabeth Blackburn, em seguida, na UC Berkeley e agora presidente emérita do Instituto Salk de Estudos Biológicos em La Jolla, Califórnia. Trabalhando com o protozoário ciliado Tetrahymena, ela e seus colegas mostraram que as extremidades dos cromossomos são tampadas por sequências repetidas de DNA. Armado com o conhecimento da sequência do telômero, os pesquisadores então mostraram que os telômeros em tecidos de organismos multicelulares ficam mais curtos cada vez que uma célula se divide. Os telômeros protegem as fitas de DNA de se desfazerem e serem danificadas em suas extremidades, muito parecido com a ponta de plástico na ponta de um cadarço. Acredita-se que o fato de eles caírem a cada divisão celular nos protege do câncer, quando uma célula é sequestrada e prolifera continuamente.
Em 1985 na UC Berkeley, Blackburn e a então estudante de graduação Carol Greider descobriram a telomerase, uma enzima que adiciona DNA de volta às extremidades dos cromossomos, alongando-os e estendendo a vida útil da célula. Chama Negra, Greider e outro colega, Jack Szosak, compartilhou o Prêmio Nobel de Fisiologia ou Medicina de 2009 pela descoberta da telomerase.
Desde então, os cientistas descobriram que, em humanos e outros organismos multicelulares, telomerase é expressa apenas no embrião, não na maioria das células adultas. Isso significa que a maioria das células no nascimento tem uma capacidade predeterminada de crescer e se dividir, após o que eles morrem. Muitos cientistas acreditam que os telômeros esgotados são uma das principais causas do envelhecimento.
Collins tem tentado determinar a estrutura da telomerase desde que a primeira proteína telomerase humana foi descoberta em 1997, e ela e seus colegas descobriram e caracterizaram extensivamente muitas das proteínas da grande enzima, bem como a estrutura em grampo do RNA da telomerase. No entanto, como todos eles se encaixam era um enigma por causa dos resultados conflitantes de muitos laboratórios diferentes.
Nguyen foi capaz de isolar a enzima ativa e purificá-la muito melhor do que qualquer pessoa tinha feito antes, e empregou um novo, microscópio crioeletrônico de última geração para determinar a estrutura da telomerase ativa de forma inequívoca. Cryo-EM é uma técnica para determinar estruturas moleculares de compostos que não podem ser cristalizados e fotografados com raios-X, e seus desenvolvedores ganharam o Prêmio Nobel de Química de 2017.
Assim que a equipe da UC Berkeley teve a estrutura, Nguyen disse, ficou claro por que as mutações genéticas em algumas das proteínas da telomerase interferem na enzima para causar doenças. Em 1999, Collins descobriu a primeira doença humana conhecida causada por uma mutação da telomerase:uma mutação em uma proteína telomerase chamada disquerina, que é responsável por uma doença rara chamada disqueratose congênita. Os pacientes desenvolvem anemia, bem como problemas de pele e intestinos, e mais freqüentemente morrem de insuficiência da medula óssea.
O motivo, Collins diz, é que existem duas moléculas de disquerina ligadas ao esqueleto do RNA que não só devem alcançar a rede de outras proteínas, mas também se tocar, e mutações causadoras de doenças impedem essas ligações, incapacitando a capacidade da estrutura do RNA de sobreviver nas células. Algumas crianças com disceratose congênita têm níveis de telomerase cerca de 25% do normal e uma vida útil de menos de duas décadas. Aqueles com metade do nível normal de telomerase normalmente atingem uma crise de saúde na meia-idade.
Collins está em êxtase por finalmente ter uma estrutura definitiva para a telomerase e espera aprender mais sobre o intrincado processo de montagem de uma das enzimas mais complexas do corpo:uma polimerase tão complicada quanto o ribossomo, que lê o RNA para produzir proteínas.
"Não pensei que seria tão complicado quando decidi estudar esta molécula, "disse ela." Fiquei curiosa sobre como a telomerase funciona em 1991, quando eu estava terminando minha graduação, e eu estava procurando um sistema de polimerase realmente simples para entender as interações do ácido nucléico. E eu pensei, meu deus, você não pode ser mais simples do que isso. Isso foi super ingênuo. "