Aqui está a tabela periódica com todos os elementos bloqueados exceto para os do grupo 15. Crédito:Julie Pollock, CC BY-SA
Quando você vê a tabela periódica, o que vem a mente? As peças em um tabuleiro de scrabble? Talvez você pense sobre sua aula de química do ensino médio. Talvez você pense na mesa colorida colada na parede de uma sala de aula na faculdade. Talvez você se lembre de seu professor favorito colocando fogo em algo na frente da sala de aula. Eu sou um professor assistente de química na University of Richmond e quando ouço a frase "a tabela periódica, "Eu penso sobre a vida.
Eu penso sobre como as moléculas e substâncias químicas que nos cercam e ditam nossas atividades diárias são compostas dos elementos dessa mesa - eles sustentam nossa vida, trazem beleza ao mundo e são vitais na medicina.
Cada coluna da tabela periódica é chamada de grupo. Cada membro do grupo tem um arranjo semelhante de elétrons que pode resultar em propriedades químicas semelhantes. O grupo 15 elementos - nitrogênio, fósforo, arsênico, antimônio, bismuto e moscópio - são interessantes para mim por causa de seu papel fundamental na vida, bem como no meu laboratório de pesquisa. Um elemento que estudamos é o fósforo por causa de seu papel integral no destino das células.
Mas antes de entrarmos nesses detalhes, vamos dar uma breve olhada em cada um dos 15 elementos do grupo. Eles são um conjunto único em sua história, usos e propriedades.
Grupo 15 - dando vida e causando morte
O nitrogênio (N) em sua forma atmosférica (N₂) compõe aproximadamente 78% do ar que respiramos. Quando as bactérias que vivem dentro das raízes das plantas as convertem em uma forma utilizável por meio de um processo denominado fixação de nitrogênio, esta forma elementar de nitrogênio é incorporada em muitos compostos que são necessários para a vida - proteínas e DNA, por exemplo. Na parte inferior da coluna está Moscovium (Mc), o que é interessante porque realmente não existe na natureza. É um elemento radioativo que só pode ser gerado em laboratório e sobrevive por menos de um segundo.
O arsênico (As) pode ser familiar para você por causa de sua associação com envenenamentos. Em 1494, Pico della Mirandola, um filósofo humanista italiano durante a Renascença, foi envenenado por arsênico, embora os detalhes sobre sua morte prematura ainda sejam debatidos. Por muito tempo, acreditou-se que Napoleão Bonaparte morreu de exposição ao arsênico em 1821, mas após extensas comparações de amostras de cabelo preservadas de diferentes estágios de sua vida, os pesquisadores concluíram que os níveis aumentados de arsênio provavelmente se deviam às técnicas de preservação da época. Mais recentemente, a Organização Mundial da Saúde estimou que a água potável contaminada com arsênico em Bangladesh resultou em mais de 9, 000 mortes em 2001. Como o arsênico envenena e mata não é completamente compreendido, mas não há dúvida de que o elemento causa a destruição dos órgãos vitais do corpo humano.
Quando o elemento antimônio (Sb) é combinado com três átomos de oxigênio para formar o trióxido de antimônio, é amplamente utilizado como retardante de chamas para móveis, tapetes, cortinas, borracha, plásticos e adesivos. Quantidades desta molécula nestes produtos domésticos tendem a ser muito pequenas, e esses níveis de antimônio são considerados seguros.
O bismuto (Bi) é um metal encontrado na mesma linha da tabela periódica que vários metais tóxicos; Contudo, compostos que contêm bismuto são inofensivos. Os compostos de bismuto podem ser encontrados em cosméticos devido ao seu brilho prateado distinto e desejável. Mesmo que você não tenha usado produtos de higiene pessoal contendo bismuto, você provavelmente o encontrou no conhecido antiácido Peptobismol, que é usado para tratar dores de estômago, ou no quarto de julho, quando você estiver assistindo a fogos de artifício. É um composto de bismuto que causa os sons crepitantes dos fogos de artifício do ovo do dragão.
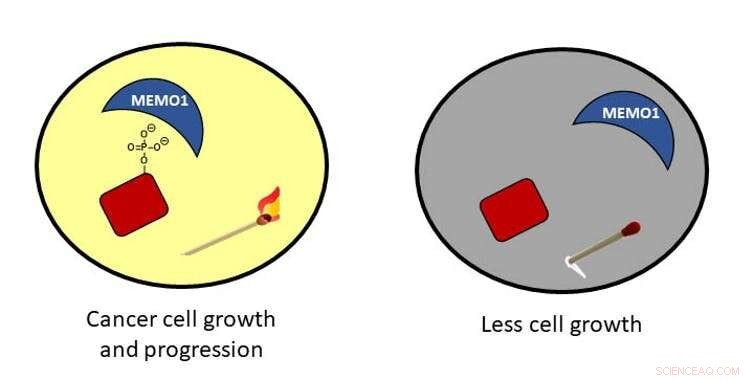
Fosforilação em células cancerosas:quando uma proteína é fosforilada, é como um fósforo aceso em uma sala que leva ao crescimento de células cancerosas. Se o fosfato for removido, o fósforo se apaga e as células não crescem tanto.
Último, mas não menos importante, dos elementos do grupo 15 é o fósforo (P). Foi descoberto em 1669 pelo alquimista Hennig Brandt e denominado da palavra grega "fósforo, "significando portador de luz. Isso porque quando a forma elemental interage com o oxigênio atmosférico, ela produz uma luz brilhante. Os químicos descobriram como aproveitar o poder dessa reação para o desenvolvimento de fósforos. A ponta vermelha de um fósforo ainda contém uma forma de fósforo hoje.
Fosfatos - regulando o destino das células cancerosas
Além das faíscas geradas pelo elemento, o fósforo é encontrado em um composto conhecido como fosfato:fósforo ligado a quatro átomos de oxigênio. Nas células, quando uma molécula de fosfato é ligada a uma proteína, pode ligar, ou ativar, a proteína para que possa desempenhar sua função na célula - como estimular o crescimento.
Quando o fosfato não está mais ligado à proteína, as células param de crescer. Você pode pensar nisso quase como as combinações descritas acima - quando o fosfato está lá, a partida pode acender e os negócios podem prosseguir. Quando o fosfato é removido, o fósforo é apenas um palito e nenhuma luz é fornecida; nem tanto trabalho pode acontecer no escuro.
Em células cancerosas, o status do fosfato está fora de controle. Imagine muitos fósforos acesos e uma sala muito iluminada que pode resultar em uma enxurrada de atividades. Essa atividade pode ter consequências graves para as células. Por exemplo, o crescimento desregulado e a migração podem levar ao câncer.
Em meu laboratório na Universidade de Richmond, estamos interessados em compreender esses fosfatos e uma proteína em particular que interage com eles. Esta proteína, chamado MEMO1, é encontrado em grandes quantidades em pacientes com câncer de mama e ajuda os fosfatos a permanecerem sempre ligados às proteínas. Estamos tentando entender como o MEMO1 interage com esses fosfatos e desenvolvendo estratégias para interromper essas interações.
Esperamos que nosso trabalho revele uma maneira de ajudar a remover os fosfatos para interromper o crescimento descontrolado de células - em outras palavras, para apagar os fósforos.
Então, da próxima vez que você ouvir as palavras "tabela periódica, "por favor, pense na vida. Pense nas moléculas que você encontra a cada momento de cada dia, pense no remédio que o mantém saudável e naqueles de nós que estão trabalhando para entender como mantê-lo assim.
Este artigo foi republicado de The Conversation sob uma licença Creative Commons. Leia o artigo original. 