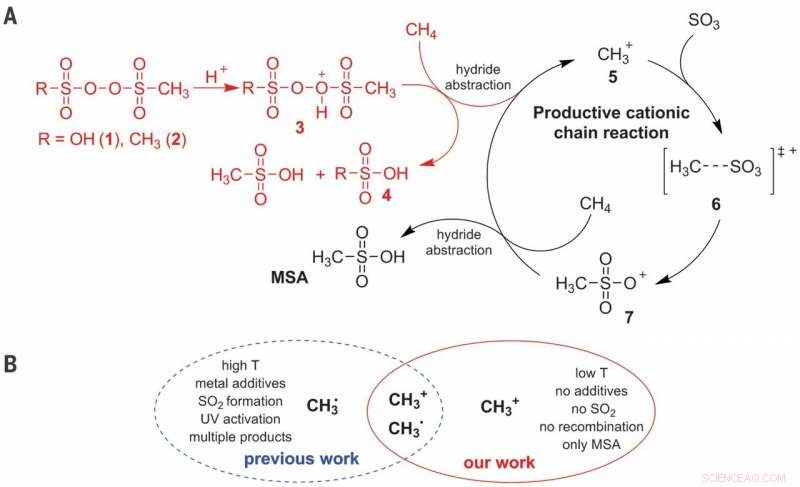
(A) Mecanismo de reação iônica proposto para a ativação C – H de CH4 na produção seletiva de MSA (ácido metanossulfônico). (B) Vantagens da via catiônica sobre a via radical. T, temperatura. Crédito:Ciência, doi:10.1126 / science.aav0177
O metano é o principal componente do gás natural e uma das moléculas mais difíceis de ativação controlada, já que a maior parte do produto resulta em dióxido de carbono. A conversão industrial de metano em derivados de álcool é normalmente baseada em uma rota tortuosa que começa com a superoxidação em monóxido de carbono. Embora abordagens mais diretas tenham se mostrado promissoras em meios altamente ácidos em pequena escala, eles não são muito econômicos. Em um estudo recente agora publicado em Ciência , Christian Díaz-Urrutia e Timo Ott do departamento de P&D da Grillo-Werke AG Company descrevem uma reação em escala de planta piloto que combinou diretamente o metano (CH 4 ) e trióxido de enxofre (SO 3 ) em ácido sulfúrico (H 2 TÃO 4 ) para formar metanossulfônico (CH 4 O 3 S) ácido sem subprodutos. A reação pareceu prosseguir por meio de um mecanismo de cadeia catiônica iniciado pela adição de uma baixa concentração de peróxido de sulfonil, propagado por metênio (CH 3 + ) moléculas.
A funcionalização direta do metano para formar produtos de valor agregado é um desafio devido à potencial superoxidação em muitos ambientes de reação e a sulfonação é uma abordagem atraente para atingir a seletividade de interesse. No processo prático, Díaz-Urrutia e Ott produziram ácido metanossulfônico (MSA) usando apenas dois reagentes principais; metano e trióxido de enxofre. Eles alcançaram 99% de seletividade e rendimento de MSA no trabalho. Os cientistas basearam o iniciador eletrofílico em um derivado de peróxido de sulfonila, que eles protonaram sob condições superacídicas para produzir um átomo de oxigênio altamente eletrofílico capaz de ativar uma ligação C-H de metano. Eles propuseram estudos mecanísticos para apoiar a formação de um cátion metênio (CH 3 + ) como um intermediário chave durante a reação. O método proposto é escalável com reatores conectados em série para produzir prospectivamente até 20 toneladas métricas de MSA por ano.
Embora as técnicas de fraturamento em grande escala e a produção de biogás tenham fornecido acesso a grandes quantidades de metano inativo, a maior transformação química do metano permanece confinada aos processos Fischer-Tropsch, que demandam muita energia. Atualmente, o metano é industrialmente convertido em Syngas, uma mistura de monóxido de carbono e hidrogênio, para formar produtos úteis, incluindo metanol e hidrocarbonetos Fischer-Tropsch, que são sintetizados em etapas subsequentes. A produção de gás de síntese é severamente limitante de custos, Contudo; As fábricas de "MegaMetanol" ou o complexo de pérolas Fischer-Tropsch no Qatar excedem 10 milhões de toneladas métricas (MT) da produção anual total de hidrocarbonetos. Como resultado, a conversão direta de metano em produtos valiosos em uma técnica economicamente viável são de extremo interesse.
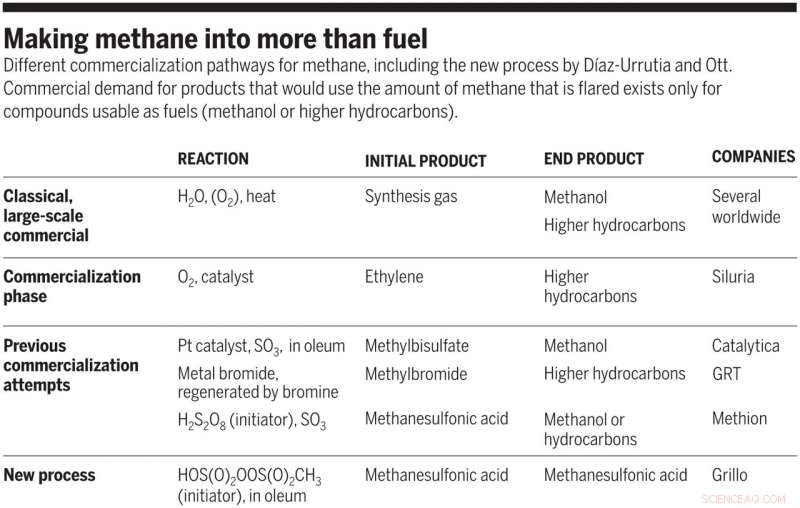
Transformando o metano em mais do que combustível. Diferentes vias de comercialização de metano, incluindo o novo processo de Díaz-Urrutia e Ott. A demanda comercial por produtos que usariam a quantidade de metano queimada existe apenas para compostos utilizáveis como combustíveis (metanol ou hidrocarbonetos superiores). Crédito:Ciência, doi:10.1126 / science.aav0177
Nesse contexto, o potencial de sulfonato de metano (CH 4 ) para ácido metanossulfônico (CH 4 O 3 S, MSA) alcançou atenção substancial devido à abundância de matérias-primas e à capacidade de sua rápida integração nos processos químicos industriais existentes. MSA é biodegradável e não oxidante, com aplicações potenciais na reciclagem de metal, armazenamento de energia e produção de biodiesel. O trabalho anterior na metanossulfonação sofreu de baixos rendimentos e conversões, devido à recombinação de radicais livres, resultando em produtos colaterais indesejados, como etano, tornar os métodos inadequados para produção em grande escala. Tecnicamente, o equilíbrio entre reatividade e seletividade exigida por um processo industrial pode ser fornecido pela química dos superácidos. Díaz-Urrutia e Ott relataram o tratamento de oleum (trióxido de enxofre de 20 a 60 por cento) com CH 4 em aproximadamente 50 0 C usando menos de 1 mol por cento do iniciador eletrofílico para formar MSA com 99 por cento de rendimento e 99 por cento de seletividade.
CH 4 (g) + SO 3 (l) → CH 3 TÃO 3 H (eu)
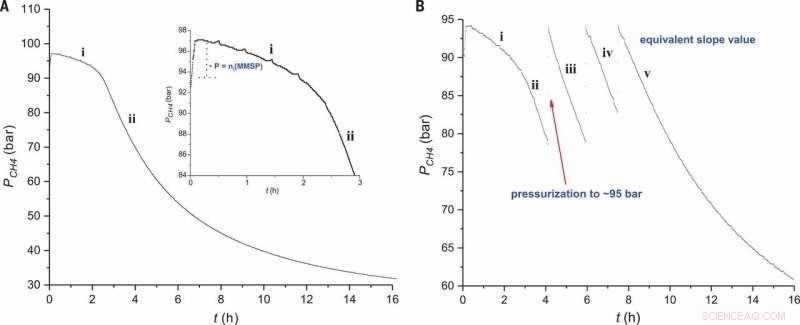
Perfil de reação para metano sulfonação. A pressão de CH4 é traçada em função do tempo sob (A) condições padrão usando 0,9 mol% de iniciador eletrofílico (Figura 2, entrada 2) e (B) adições sucessivas de CH4 (Fig 2, entrada 3). A inserção em (A) mostra uma visão ampliada da região i. Crédito:Ciência, doi:10.1126 / science.aav0177.
Os cientistas primeiro estudaram a reação em um sistema de lote para otimizar as condições experimentais e obter mais informações sobre o mecanismo de reação. Para o iniciador eletrofílico, eles usaram ácido sulfúrico monometilsulfonilperóxido (MMSP) para melhorar a viabilidade técnica. Para aumentar a produtividade, eles usaram um reator de quatro litros em vez de um reator de 400 mL, devido a grandes quantidades de CH 4 se formando no espaço superior do reator maior. Os cientistas foram, portanto, capazes de manter quantidades constantes de metano ao longo da reação para rendimentos mais elevados de MSA. Eles usaram uma temperatura ideal de 50 0 C para alcançar mais de 99 por cento de seletividade em relação ao MSA, enquanto as vias radicais anteriores tiveram resultados semelhantes em temperaturas mais altas (85 0 C) devido à decomposição térmica do iniciador eletrofílico de peróxido de sulfonila. Os experimentos de baixa temperatura também podem oferecer alta conversão e seletividade MSA, mas requeria tempos de reação mais longos. Díaz-Urrutia e Ott comparativamente forneceram insights para apoiar um mecanismo não radical no presente trabalho.
Quando os cientistas examinaram o perfil de reação do experimento, eles observaram um período de indução imediatamente após a adição do reator eletrofílico, onde a quantidade de MSA (produto) foi proporcional à quantidade inicial de MMSP (iniciador). No estágio dois do perfil de reação, eles observaram a solubilidade de CH 4 diminuir com o aumento da pressão no reator. A energia de ativação do processo foi determinada como sendo 111 ± 1 kJ / mol, semelhantes aos relatados anteriormente. A via catiônica descrita ocorreu em condições muito específicas. Os pesquisadores alcançaram alta seletividade por meio de mudanças eletrônicas em substituições eletrofílicas, ao contrário das reações de abstração de átomos baseadas em radicais livres anteriormente relatadas.

Sulfonação de metano para MSA. (A) Esquema do processo Díaz-Urrutia e Ott. A reação prossegue como uma cascata através de reatores conectados em série. A planta piloto pode produzir até 20 toneladas métricas de MSA por ano. O excesso de SO3 é extinto no reator Q, a corrente em excesso de CH4 e a corrente de depósito MSA / H2SO4 são recicladas de volta para o reator 1, e a mistura enriquecida com MSA é destilada na coluna D para obter MSA puro. (B) A concentração de MSA aumenta à medida que passa pelos reatores. (C) Reator de janela de quartzo oblongo com impulsor de gás, para melhorar a mistura de CH4. Crédito:Ciência, doi:10.1126 / science.aav0177.
Como os resultados iniciais foram muito promissores, os cientistas construíram uma instalação de planta piloto e testaram a viabilidade técnica e econômica da produção de MSA em escala industrial. Díaz-Urrutia e Ott construíram a planta com capacidade projetada de 20 toneladas / ano de produção MSA, com base em suas reações em lote em escala de laboratório, e foi responsável pela solubilidade e reciclagem do metano, bem como para a concentração de trióxido de enxofre e metano. Essa configuração permitiu aos cientistas aumentar constantemente a concentração de MSA conforme a mistura de reação passava pelos reatores. Quando eles usaram cromatografia de gás com detecção de ionização de chama (GC-FID) para monitorar as amostras, eles não detectaram a presença de alcanos superiores na corrente reciclada de metano ou quaisquer outros produtos de recombinação radical, permitindo seu uso direto como estoque de feedback para a reação em cascata.
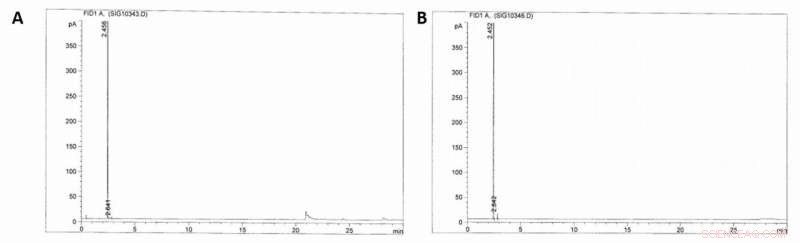
Cromatogramas GC-FID. A) Cromatograma GC-FID da fase gasosa do reator (100 bar) antes de ocorrer a sulfonação do metano. B) Cromatograma GC-FID da fase gasosa após (~ 40 bar) a sulfonação do metano ter ocorrido (16 h, ácido sulfúrico fumante 36%, 500C). Crédito:Ciência, doi:10.1126 / science.aav0177.
Para pagar MSA puro, Díaz-Urrutia e Ott completaram o processo com uma etapa final de destilação. Eles então reciclaram a mistura restante de ácido sulfúrico e MSA para o primeiro reator para regeneração contínua de trióxido de enxofre e ácido sulfúrico (SO 3 e H 2 TÃO 4 ) Usando as quatro câmaras de reação da configuração, os cientistas foram capazes de produzir 200 kg de MSA puro por semana, no valor de duas a três toneladas métricas em 80 dias. Desta maneira, a combinação demonstrada de alta seletividade, a conversão e a economia de átomos tornaram o processo ideal para a valorização em grande escala dos reagentes de metano e trióxido de enxofre prontamente disponíveis.
Se este novo processo de ácido metanossulfônico fizer sucesso no mercado, reagentes mais baratos serão capazes de substituir os ácidos minerais atualmente em uso. Contudo, mesmo se a produção de MSA aumentasse dramaticamente, a quantidade de metano consumido no processo ainda seria diminuída pelas quantidades queimadas. No entanto, o trabalho de Díaz-Urrutia e Ott prevê um novo processo químico sintético para sintetizar um produto químico interessante, permitindo aos cientistas imaginar uma gama de produtos de valor agregado derivados do metano ou alcanos superiores usando esta rota da química dos superácidos no futuro.
© 2019 Science X Network