
O professor assistente do MIT Betar Gallant (à esquerda) e a estudante graduada Aliza Khurram estão desenvolvendo uma nova bateria que pode capturar dióxido de carbono no escapamento da usina de energia e convertê-lo em um sólido pronto para o descarte seguro. Crédito:Stuart Darsch
Reduzindo o dióxido de carbono (CO 2 ) as emissões de usinas de energia são amplamente consideradas um componente essencial de qualquer plano de mitigação de mudanças climáticas. Muitos esforços de pesquisa se concentram no desenvolvimento e implantação de sistemas de captura e sequestro de carbono (CCS) para manter o CO 2 emissões de usinas de energia fora da atmosfera. Mas separar o CO capturado 2 e convertê-lo de volta em um gás que pode ser armazenado pode consumir até 25% da capacidade de geração de energia de uma usina. Além disso, o CO 2 o gás é geralmente injetado em formações geológicas subterrâneas para armazenamento de longo prazo - um método de descarte cuja segurança e confiabilidade permanecem não comprovadas.
Uma abordagem melhor seria converter o CO capturado 2 em produtos úteis, como combustíveis ou produtos químicos com valor agregado. Para esse fim, a atenção se concentrou nos processos eletroquímicos - neste caso, um processo no qual as reações químicas liberam energia elétrica, como na descarga de uma bateria. O meio ideal para conduzir a conversão eletroquímica de CO 2 pareceria ser água. A água pode fornecer os prótons (partículas com carga positiva) necessários para fazer combustíveis como o metano. Mas o funcionamento de tais sistemas "aquosos" (à base de água) requer grandes entradas de energia, e apenas uma pequena fração dos produtos formados são tipicamente os de interesse.
Betar Gallant, um professor assistente de engenharia mecânica, e seu grupo no MIT, portanto, têm se concentrado em reações eletroquímicas não aquosas (sem água) - em particular, aqueles que ocorrem dentro de lítio-CO 2 baterias.
Pesquisa em lítio-CO 2 baterias está em seus estágios iniciais, de acordo com Gallant, mas o interesse por eles está crescendo porque o CO 2 é usado nas reações químicas que ocorrem em um dos eletrodos quando a bateria está sendo descarregada. Contudo, CO 2 não é muito reativo. Os pesquisadores tentaram acelerar as coisas usando diferentes eletrólitos e materiais de eletrodo. Apesar de tais esforços, persistiu a necessidade de usar catalisadores de metal caros para eliciar a atividade eletroquímica.
Dada a falta de progresso, Gallant queria tentar algo diferente. "Estávamos interessados em tentar trazer uma nova química para resolver o problema, "diz ela. E contando com a ajuda das moléculas sorventes que capturam CO de maneira tão eficaz 2 no CCS parecia um caminho promissor.
Repensando amina
A molécula sorvente usada no CCS é uma amina, um derivado da amônia. No CCS, a exaustão é borbulhada através de uma solução contendo amina, e a amina se liga quimicamente ao CO 2 , removê-lo dos gases de exaustão. O CO 2 - agora na forma líquida - é então separado da amina e convertido de volta em um gás para descarte.

A aluna de graduação Aliza Khurram se prepara para experimentos bombeando dióxido de carbono através de uma célula eletroquímica que consiste em eletrodos de lítio e carbono, além de um eletrólito especialmente projetado. Crédito:Stuart Darsch
No CCS, essas últimas etapas requerem altas temperaturas, que são obtidos usando parte da produção elétrica da usina. Gallant se perguntou se sua equipe poderia usar reações eletroquímicas para separar o CO 2 da amina - e, em seguida, continue a reação para formar um sólido, CO 2 -contendo o produto. Se então, o processo de descarte seria mais simples do que para o CO gasoso 2 . O CO 2 seria mais densamente compactado, então ocuparia menos espaço, e não podia escapar, então seria mais seguro. Melhor ainda, energia elétrica adicional pode ser extraída do dispositivo conforme ele descarrega e forma o material sólido. "A visão era colocar um dispositivo semelhante a uma bateria no fluxo de resíduos da usina para sequestrar o CO capturado 2 em um sólido estável, ao colher a energia liberada no processo, "diz Gallant.
A pesquisa sobre a tecnologia CCS gerou uma boa compreensão do processo de captura de carbono que ocorre dentro de um sistema CCS. Quando CO 2 é adicionado a uma solução de amina, moléculas das duas espécies se combinam espontaneamente para formar um "aduto, "uma nova espécie química na qual as moléculas originais permanecem praticamente intactas. Neste caso, o aduto se forma quando um átomo de carbono em um CO 2 molécula se liga quimicamente a um átomo de nitrogênio em uma molécula de amina. À medida que eles se combinam, o CO 2 molécula é reconfigurada:ela muda de seu original, altamente estável, forma linear para uma forma "dobrada" com uma carga negativa - uma forma altamente reativa que está pronta para novas reações.
Em seu esquema, Gallant propôs o uso de eletroquímica para separar o CO 2 aduto de amina - bem na ligação carbono-nitrogênio. A clivagem do aduto nessa ligação separaria as duas peças:a amina em seu original, estado não reagido, pronto para capturar mais CO 2 , e a curva, forma quimicamente reativa de CO 2 , que pode então reagir com os elétrons e íons de lítio carregados positivamente que fluem durante a descarga da bateria. O resultado dessa reação pode ser a formação de carbonato de lítio (Li 2 CO 3 ), que se depositaria no eletrodo de carbono.
Ao mesmo tempo, as reações no eletrodo de carbono devem promover o fluxo de elétrons durante a descarga da bateria - mesmo sem um catalisador de metal. “A descarga da bateria ocorreria espontaneamente, "Gallant diz." E quebraríamos o aduto de uma forma que nos permitisse renovar nosso CO 2 absorvente enquanto toma CO 2 para um estábulo, forma sólida. "
Um processo de descoberta
Em 2016, Aliza Khurram, aluna do doutorado em engenharia mecânica e galã, começou a explorar essa ideia.
Seu primeiro desafio foi desenvolver um novo eletrólito. Um lítio-CO 2 bateria consiste em dois eletrodos - um ânodo feito de lítio e um cátodo feito de carbono - e um eletrólito, uma solução que ajuda a transportar partículas carregadas para frente e para trás entre os eletrodos conforme a bateria é carregada e descarregada. Para seu sistema, eles precisavam de um eletrólito feito de amina mais CO capturado 2 dissolvido em um solvente - e precisava promover reações químicas no cátodo de carbono à medida que a bateria descarregava.
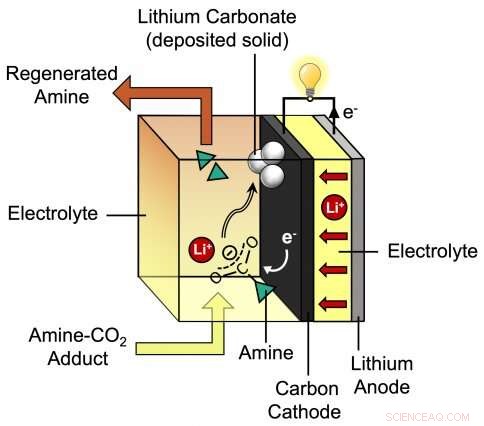
Este diagrama descreve o processo durante a descarga da nova bateria de lítio-CO2 desenvolvida pelo professor assistente do MIT Betar Gallant e seu grupo. A bateria proposta pelos pesquisadores consiste em um ânodo de lítio mais um cátodo de carbono que é cercado por um eletrólito especial que incorpora íons de lítio (Li +) e amina. Crédito:Massachusetts Institute of Technology
Eles começaram testando possíveis solventes. Eles misturaram seu CO 2 -absorção de amina com uma série de solventes frequentemente usados em baterias e, em seguida, CO borbulhado 2 através da solução resultante para ver se CO 2 pode ser dissolvido em altas concentrações neste ambiente químico não convencional. Nenhuma das soluções de amina-solvente exibiu mudanças observáveis quando o CO 2 foi introduzido, sugerindo que todos eles podem ser candidatos a solventes viáveis.
Contudo, para que qualquer dispositivo eletroquímico funcione, o eletrólito deve ser enriquecido com um sal para fornecer íons carregados positivamente. Porque é uma bateria de lítio, os pesquisadores começaram adicionando um sal à base de lítio - e os resultados experimentais mudaram dramaticamente. Com a maioria dos candidatos a solvente, adicionar o sal instantaneamente fazia com que a mistura formasse precipitados sólidos ou se tornasse altamente viscosa - resultados que os descartavam como solventes viáveis. A única exceção foi o solvente dimetilsulfóxido, ou DMSO. Mesmo quando o sal de lítio estava presente, o DMSO poderia dissolver a amina e CO 2 .
"Descobrimos que - fortuitamente - o sal à base de lítio foi importante para permitir que a reação ocorresse, "diz Gallant." Há algo sobre o íon de lítio carregado positivamente que coordena quimicamente com a amina-CO 2 aduto, e, juntas, essas espécies tornam as espécies eletroquimicamente reativas. "
Explorando o comportamento da bateria durante a descarga
Para examinar o comportamento de descarga de seu sistema, os pesquisadores montaram uma célula eletroquímica que consiste em um ânodo de lítio, um cátodo de carbono, e seu eletrólito especial - para simplificar, já carregado com CO 2 . Eles então rastrearam o comportamento de descarga no cátodo de carbono.
Como eles esperavam, seu eletrólito especial realmente promoveu a reação de descarga na célula de teste. "Com a amina incorporada ao eletrólito à base de DMSO junto com o sal de lítio e o CO 2 , vemos capacidades muito altas e tensões de descarga significativas - quase três volts, "diz Gallant. Com base nesses resultados, eles concluíram que seu sistema funciona como um lítio-CO 2 bateria com capacidades e tensões de descarga competitivas com as baterias de lítio-gás de última geração.
A próxima etapa foi confirmar se as reações estavam de fato separando a amina do CO 2 e continuar a reação para produzir CO 2 produtos derivados. Descobrir, os pesquisadores usaram uma variedade de ferramentas para examinar os produtos que se formaram no cátodo de carbono.

Esta imagem de microscópio eletrônico de varredura (SEM) mostra o cátodo do sistema de dióxido de lítio-carbono dos pesquisadores após a descarga. A análise das estruturas esféricas confirma que elas são compostas por Li2CO3. A inserção mostra uma imagem SEM do cátodo de carbono antes da descarga. A ausência das esferas confirma que foram formadas durante a descarga. Crédito:Massachusetts Institute of Technology
Em um teste, eles produziram imagens da superfície catódica pós-reação usando um microscópio eletrônico de varredura (MEV). Imediatamente evidentes foram as formações esféricas com um tamanho característico de 500 nanômetros, regularmente distribuído na superfície do cátodo. De acordo com Gallant, a estrutura esférica observada do produto de descarga era semelhante à forma de Li 2 CO 3 observada em outras baterias de lítio. Essas esferas não eram evidentes em imagens SEM do cátodo de carbono "puro" tiradas antes das reações ocorrerem.
Outras análises confirmaram que o sólido depositado no cátodo era Li 2 CO 3 . Inclui apenas CO 2 -materiais derivados; nenhuma molécula de amina ou produtos derivados delas estavam presentes. Tomados em conjunto, esses dados fornecem fortes evidências de que a redução eletroquímica do CO 2 A amina carregada ocorre por meio da clivagem seletiva da ligação carbono-nitrogênio.
"A amina pode ser considerada como ativando efetivamente a reatividade do CO 2 , "diz Gallant." Isso é emocionante porque a amina comumente usada em CO 2 a captura pode então realizar duas funções críticas. Pode servir como absorvedor, recuperando CO espontaneamente 2 dos gases de combustão e incorporá-los à solução eletrolítica. E pode ativar o CO 2 para outras reações que não seriam possíveis se a amina não estivesse lá. "
Direções futuras
Gallant enfatiza que o trabalho até o momento representa apenas um estudo de prova de conceito. "Ainda há muita ciência fundamental para entender, " ela diz, antes que os pesquisadores possam otimizar seu sistema.
Ela e sua equipe continuam investigando as reações químicas que ocorrem no eletrólito, bem como a composição química do aduto que se forma - o "estado reagente" no qual a eletroquímica subsequente é realizada. Eles também estão examinando o papel detalhado da composição do sal.
Além disso, há questões práticas a serem consideradas quando eles pensam sobre o design do dispositivo. Um problema persistente é que o depósito sólido rapidamente obstrui o cátodo de carbono, portanto, outras reações químicas não podem ocorrer. Em uma configuração que eles estão investigando - um projeto de bateria recarregável - o cátodo é descoberto durante cada ciclo de descarga-carga. As reações durante a descarga depositam o Li sólido 2 CO 3 , e as reações durante o carregamento o retiram, colocar os íons de lítio e CO 2 de volta ao eletrólito, pronto para reagir e gerar mais eletricidade. Contudo, o CO capturado 2 é então de volta à sua forma gasosa original no eletrólito. Selar a bateria bloquearia esse CO 2 dentro, longe da atmosfera, mas apenas até certo ponto CO 2 pode ser armazenado em uma determinada bateria, portanto, o impacto geral do uso de baterias para capturar CO 2 as emissões seriam limitadas neste cenário.

Os pesquisadores usam essa configuração para testar a capacidade de armazenamento e a tensão de descarga de suas baterias. Crédito:Stuart Darsch
A segunda configuração que os pesquisadores estão investigando - uma configuração apenas de descarga - aborda esse problema ao nunca permitir o CO gasoso 2 reformar. "Somos engenheiros mecânicos, então, o que realmente queremos fazer é desenvolver um processo industrial em que você possa, de alguma forma, colher mecanicamente ou quimicamente o sólido à medida que ele se forma, "Gallant diz." Imagine se por vibração mecânica você pudesse remover suavemente o sólido do cátodo, mantendo-o limpo para uma reação sustentada. "Colocado dentro de um fluxo de exaustão, tal sistema poderia remover continuamente o CO 2 emissões, gerar eletricidade e talvez produzir materiais sólidos valiosos ao mesmo tempo.
Gallant e sua equipe agora estão trabalhando nas duas configurações do sistema. "Ainda não sabemos o que é melhor para os aplicativos, "ela diz. Embora ela acredite que o lítio-CO prático 2 as baterias ainda estão a anos de distância, ela está animada com os primeiros resultados, que sugerem que o desenvolvimento de novos eletrólitos para pré-ativar o CO 2 poderia levar a CO alternativo 2 vias de reação. E ela e seu grupo já estão trabalhando em alguns.
Um dos objetivos é substituir o lítio por um metal que seja menos caro e mais abundante em terra, como sódio ou cálcio. Com financiamento inicial da Iniciativa de Energia do MIT, a equipe já começou a olhar para um sistema baseado em cálcio, um material que ainda não foi bem desenvolvido para aplicações de bateria. Se o cálcio-CO 2 a configuração funciona como eles prevêem, o sólido que se forma seria carbonato de cálcio - um tipo de rocha agora amplamente usado na indústria de construção.
Enquanto isso, Gallant e seus colegas estão satisfeitos por terem encontrado o que parece ser uma nova classe de reações para capturar e sequestrar CO 2 . "CO 2 a conversão foi amplamente estudada ao longo de muitas décadas, " ela diz, "por isso, estamos entusiasmados em pensar que podemos ter encontrado algo que é diferente e nos fornece uma nova janela para explorar este tópico."
Esta história foi republicada por cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisas do MIT, inovação e ensino.