Evolução direcionada de uma enzima projetada com um aminoácido catalítico não natural
 p Crédito:Wiley
p Crédito:Wiley
p As taxas de conversão impressionantemente altas de enzimas naturais resultam parcialmente do aumento da atividade catalítica de algumas cadeias laterais de aminoácidos selecionados por meio do posicionamento preciso dentro da cavidade de ligação de proteínas. Os cientistas demonstraram agora que esse ajuste fino também é possível para enzimas "projetadas" com aminoácidos catalíticos não naturais. No jornal
Angewandte Chemie , eles relatam que a "evolução" laboratorial de uma enzima projetada com uma cadeia lateral de anilina levou a variantes com atividade significativamente maior. p A velocidade e seletividade com que as enzimas na natureza catalisam as conversões são invejáveis. Para aumentar cataliticamente as reações não naturais, os pesquisadores imitam enzimas com a ajuda de estruturas protéicas realizadas por projeto de proteínas auxiliado por computador. Otimização adicional é alcançada por meio da repetição de um ciclo darwiniano:1) diversificação por meio de mutação, 2) identificação de catalisadores melhorados, e 3) amplificação das variantes enzimáticas mais eficientes. Isso permite a produção de enzimas projetadas com atividades muito elevadas.
p Pesquisadores liderados por Clemens Mayer e Gerard Roelfes na Universidade de Groningen (Holanda) demonstraram agora que este tipo de evolução dirigida também é um método para melhorar a eficiência de uma nova classe de enzimas projetadas:enzimas que contêm um aminoácido que é não utilizado pela natureza.
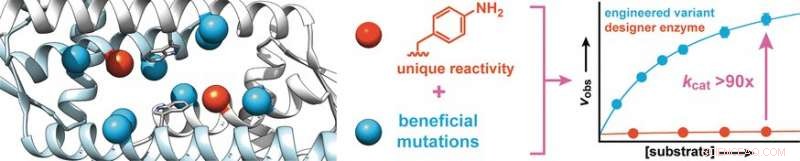
p Começando com uma proteína de Lactococcus lactis, uma bactéria usada na produção de produtos lácteos, como queijo e leitelho, os pesquisadores sintetizaram uma enzima projetada que contém um aminoácido com uma cadeia lateral de anilina abiótica (aminofenilalanina). Como anilina grátis, este aminoácido catalisa a reação de aldeídos com hidrazinas ou hidroxilaminas para formar hidrazonas ou oximas, respectivamente.
p Para aumentar a atividade da enzima, os pesquisadores produziram variantes de enzimas com mutações em aminoácidos próximos à cadeia lateral da anilina. A triagem de cerca de 400 mutantes rendeu dois candidatos com melhor atividade, um dos quais foi submetido a uma segunda rodada evolutiva. Isso levou à descoberta de mutações mais benéficas. Para identificar efeitos sinérgicos, múltiplas mutações favoráveis foram combinadas para produzir variantes adicionais. Desta maneira, foi possível aumentar a taxa de conversão da enzima por um fator de 90.
p Os pesquisadores enfatizam que, semelhante a enzimas naturais, "este aumento drástico é baseado no fortalecimento da atividade catalítica inerente da cadeia lateral da anilina. Pretendemos usar este princípio para incorporar outros catalisadores orgânicos como cadeias laterais em enzimas, e usar a evolução direcionada para convertê-las em enzimas projetistas altamente eficazes que podem realizar de forma rápida e eficiente reações sinteticamente importantes que, de outra forma, seriam executadas muito lentamente. "
