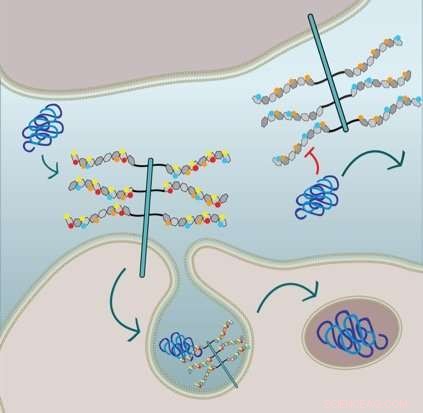
A figura mostra que a absorção de fibrila tau celular requer 6-O-sulfatação e N-sulfatação das cadeias laterais de HSPG:A célula na metade inferior expressa HSPGs com todas as frações de sulfato e internaliza tau por meio de macropinocitose. A célula na metade superior é geneticamente modificada e carece de N-sulfatação (círculos vermelhos) e 6-O-sulfatação (círculos amarelos) e, portanto, a absorção da fibrila tau é inibida. Crédito:Sandi Jo Estill-Terpack, Barbara Stopschinsky
Os vampiros podem transformar humanos em vampiros, mas para entrar na casa de um humano, eles devem ser convidados a entrar. Pesquisadores do UT Southwestern Medical Center, escrevendo no Journal of Biological Chemistry , descobriram detalhes de como as células convidam para dentro de proteínas corrompidas que podem corromper as proteínas normais, levando a doenças neurodegenerativas, como doenças de Alzheimer e Parkinson. Compreender os detalhes moleculares de como essas proteínas se propagam de uma célula para outra pode levar a terapias para interromper a progressão da doença.
Alzheimer e Parkinson estão associados a proteínas específicas no cérebro com dobramento incorreto, agregando, e induzindo proteínas normais a dobrar mal e agregar. O grupo de Marc Diamond na UT Southwestern descobriu em 2013 que, para entrar em novas células e propagar o dobramento incorreto, as proteínas tau associadas à doença, alfa-sinucleína e beta-amiloide devem se ligar a um tipo de molécula de proteína de açúcar chamada proteoglicano de sulfato de heparano (HSPG) na superfície da célula. Essa ligação faz com que a célula traga a proteína corrompida para dentro. No novo estudo, o grupo buscou entender mais sobre como funcionava esse processo.
"A questão era, quão específico é este (processo)? Ou não é específico? "Perguntou Barbara Stopschinski, o médico e pesquisador do laboratório de Diamond que supervisionou o novo trabalho. Quais foram os detalhes da comunicação química entre o HSPG e a tau que desencadeou a entrada da tau nas células? E esse processo foi diferente para alfa-sinucleína (associada à doença de Parkinson), beta-amilóide e tau (ambos associados à doença de Alzheimer)?
HSPGs podem ser de diferentes tamanhos e estruturas; eles podem ser decorados com diferentes padrões de açúcares, e os próprios açúcares podem conter diferentes padrões de grupos contendo enxofre (porções de sulfato). Stopschinski testou sistematicamente como diferentes padrões de porções de sulfato afetaram a ligação e a absorção em células de alfa-sinucleína, beta-amilóide e tau.
Ela descobriu que tau mal dobrada poderia entrar nas células apenas por meio de um HSPG modificado e decorado de forma muito específica. Amilóide-beta e alfa-sinucleína, por outro lado, eram mais flexíveis nos tipos de metades de sulfato que desencadeavam sua absorção. Além disso, Stopschinski identificou as enzimas nas células que criaram padrões de sulfatação específicos em HSPGs. Quando essas enzimas foram removidas, tau mal dobrado não era mais absorvido pelas células, presumivelmente porque as decorações de açúcar HSPG e os padrões de sulfatação mudaram, o que significa que o tau mal dobrado não sabia mais a senha molecular.
A equipe agora quer entender se esses processos funcionam no cérebro da mesma maneira que em culturas de células cerebrais. Diamond espera que a compreensão de como as proteínas corrompidas se movem entre as células cerebrais levará a maneiras de detê-las.
"Há algo muito notável sobre a eficiência com que uma célula absorve esses agregados, traga-os para dentro e use-os para fazer mais, "Disse Diamond." Este conhecimento tem implicações importantes para a nossa compreensão de como as doenças neurodegenerativas pioram com o tempo. Como identificamos enzimas específicas que podem ser inibidas para bloquear esse processo, isso pode levar a novas terapias. "