
Estrutura química completa do receptor da dopamina 2 ligado ao antipsicótico risperidona. Crédito:Roth Lab, UNC School of Medicine
Embora os medicamentos antipsicóticos estejam entre os medicamentos mais amplamente prescritos, indivíduos com esquizofrenia, transtorno bipolar e transtornos do espectro do autismo costumam apresentar efeitos colaterais graves porque as drogas interagem com dezenas de outros receptores cerebrais. Agora, cientistas da UNC School of Medicine e da UC San Francisco (UCSF) resolveram a primeira estrutura cristalina de alta resolução do receptor de dopamina 2 (DRD2) ligado ao antipsicótico risperidona, rendendo uma ferramenta tão esperada para desenvolvedores de medicamentos, psiquiatras, e neurocientistas.
A pesquisa, publicado em Natureza , permitirá que os pesquisadores ativem seletivamente o DRD2, limitando potencialmente uma série de efeitos colaterais graves de drogas antipsicóticas, como ganho de peso, ansiedade, tontura, problemas digestivos graves, agitação, e muitos outros.
“Se quisermos criar medicamentos melhores, o primeiro passo é ver a aparência do receptor D2 em detalhes de alta resolução quando está fortemente ligado a uma droga, "disse o autor sênior Bryan L. Roth, MD, PhD, o Michael Hooker Distinguido Professor de Proteína Terapêutica e Proteômica Translacional na UNC School of Medicine. “Agora temos a estrutura, e estamos explorando para encontrar novos compostos que esperamos possam ajudar milhões de pessoas que precisam de melhores tratamentos. "
Cerca de 30 por cento dos medicamentos no mercado ativam os receptores acoplados à proteína G na superfície das células e acionam os sinais químicos dentro das células para produzir seus efeitos terapêuticos. Para medicamentos antipsicóticos, um efeito é o alívio dos sintomas psicóticos associados à esquizofrenia, transtorno bipolar e muitas outras doenças psiquiátricas. Infelizmente, porque os cientistas não entenderam as diferenças estruturais entre os muitos tipos diferentes de receptores no cérebro, a maioria dos medicamentos não pode ser projetada para atingir apenas um tipo de receptor; eles interagem não apenas com o DRD2, mas uma miríade de outra dopamina, serotonina, histamina, e receptores alfa adrenérgicos, levando a efeitos colaterais graves.
DRD2 foi submetido a extensos estudos por 30 anos, mas até agora os pesquisadores não tinham uma estrutura de alta resolução do DRD2 anexado a um composto. A risperidona é um medicamento antipsicótico comumente prescrito, aprovado pela FDA para uso em esquizofrenia, transtorno bipolar, e transtorno do espectro do autismo. A risperidona também é um dos poucos medicamentos antipsicóticos "atípicos" aprovados para uso em crianças.
"Com esta estrutura de alta resolução em mãos, prevemos a descoberta de compostos que interagem com DRD2 de maneiras específicas importantes para maiores ações terapêuticas e menos efeitos colaterais, "Roth disse.
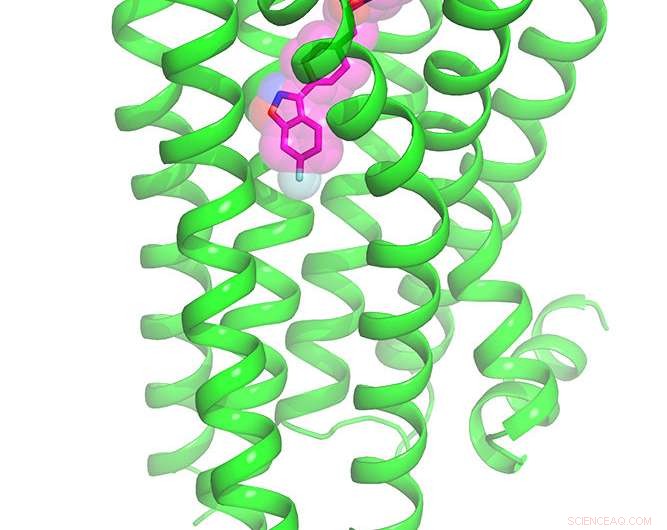
Ilustração do receptor da dopamina 2 ligado ao antipsicótico risperidona. Crédito:Roth Lab, UNC School of Medicine
Normalmente, os cientistas resolvem a estrutura química das proteínas usando uma técnica chamada cristalografia de raios-X. Eles usam abordagens experimentais para induzir a proteína a se condensar em uma estrutura de cristal compactada, em seguida, atire raios-x no cristal, e finalmente calcular a estrutura da proteína a partir dos padrões de difração resultantes. Contudo, fazer com que a proteína DRD2 cristalizasse com uma droga ligada a ela tinha sido impossível por décadas porque os receptores são proteínas notoriamente instáveis - pequenas, frágil, e normalmente em movimento enquanto se ligam a compostos.
Para transcender os desafios técnicos, Roth e colegas da UNC, incluindo pós-doutorado Sheng Wang, PhD, e Daniel Wacker, PhD, conduziu uma série de estudos meticulosos ao longo de vários anos - descritos no Natureza papel - para persuadir o DRD2 a cristalizar enquanto fortemente ligado à risperidona.
Assim que obtiveram a imagem de alta resolução, eles puderam ver que a risperidona se liga ao DRD2 de uma forma totalmente inesperada. Mais modelagem computacional realizada pelos pesquisadores da UCSF Brian Shoichet, PhD, e Anat Levit, PhD, revelou que o modo de ligação da risperidona era imprevisível - havia uma bolsa previamente invisível no receptor que Roth e seus colegas acham que poderia ser direcionada para criar medicamentos mais seletivos.
"Agora que podemos ver as diferenças estruturais entre receptores semelhantes, como o receptor de dopamina D4 e DRD2, podemos imaginar novos métodos para a criação de compostos que se ligam apenas ao DRD2 sem interagir com dezenas de outros receptores cerebrais ", disse Wacker, co-autor correspondente do estudo. "Este é precisamente o tipo de informação de que precisamos para criar uma terapêutica mais segura e eficaz."
Os efeitos adversos dos medicamentos antipsicóticos incluem sintomas extrapiramidais, como o movimento muscular involuntário parkinsoniano. Wang disse, "Agora que resolvemos a estrutura da risperidona ligada ao DRD2, estamos tendo uma ideia de como esses efeitos colaterais podem ser evitados. "
Roth acrescentou, “Antes de vir para a UNC, Eu era um psiquiatra especializado no tratamento da esquizofrenia. Diariamente, ficava claro para mim que os medicamentos eram apenas modestamente eficazes para um grande número de pacientes. Nossa falta de conhecimento sobre como os medicamentos antipsicóticos se ligam a seus receptores impediu o progresso no sentido de criar medicamentos mais eficazes. Resolver a estrutura de cristal de alta resolução do DRD2 ligado ao medicamento antipsicótico comumente prescrito risperidona é o primeiro passo para a criação de medicamentos mais seguros e eficazes para a esquizofrenia e distúrbios relacionados. "