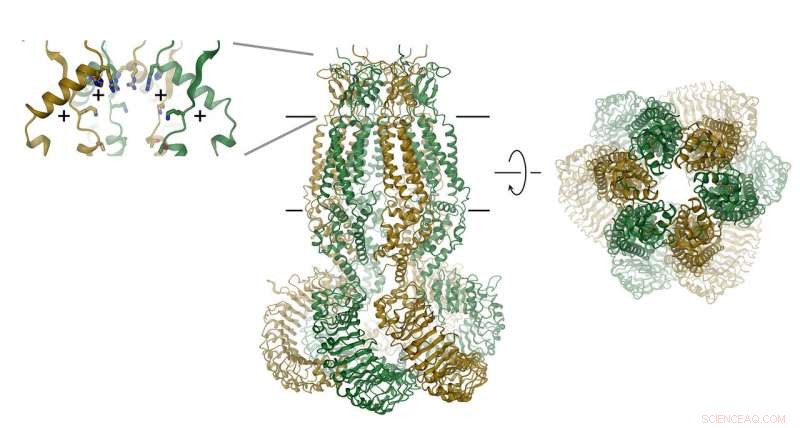
A proteína, que consiste em seis subunidades, é mostrado como uma fita. A posição da membrana é indicada por linhas. O filtro de seletividade é representado como inserção (direita). As posições dos aminoácidos carregados positivamente são indicadas com (+). Crédito:Raimund Dutzler, UZH
Os bioquímicos da Universidade de Zurique determinaram a estrutura detalhada de um canal de cloreto regulado por volume. Esta válvula celular é ativada em resposta ao inchaço para evitar que a célula se rompa. A proteína também desempenha um papel importante na captação de quimioterápicos e na liberação de neurotransmissores após um acidente vascular cerebral. A regulação controlada de sua atividade, portanto, abre uma estratégia promissora para novas terapias.
As células humanas são envolvidas por membranas e estão em equilíbrio osmótico com seu ambiente. Se a concentração de moléculas de soluto (osmolaridade) no fluido ao redor das células diminuir, as células começam a inchar; em casos extremos, isso pode resultar no estouro das células. Para evitar isso, as células ativam canais de cloreto regulados por volume (VRACs) da família de proteínas LRRC8. Se o volume da célula aumenta como resultado do influxo de água, essas válvulas celulares se abrem para permitir que os íons de cloreto carregados negativamente e os osmólitos não carregados fluam para fora, retornando a célula ao seu estado original.
Embora descoberto apenas cinco anos atrás, propriedades importantes dessas válvulas celulares já foram descritas. Por exemplo, sabe-se que, além de seu papel na regulação do volume, VRACs desempenham um papel importante para a absorção de drogas usadas na terapia do câncer e são responsáveis pela liberação descontrolada de neurotransmissores após um acidente vascular cerebral. Apesar desses avanços, a composição molecular dos VRACs e a base para sua seletividade permaneceram indefinidas. Pesquisadores do Departamento de Bioquímica da Universidade de Zurique já fecharam essa lacuna em nosso entendimento. Usando microscopia crioeletrônica e cristalografia de raios-X, a equipe liderada pelo Prof. Raimund Dutzler determinou a estrutura molecular detalhada de um VRAC. Além disso, os pesquisadores analisaram as propriedades funcionais da proteína por meio de técnicas eletrofisiológicas.
VRACs consistem em seis subunidades, que são dispostos em torno de um eixo que define o poro de permeação de íons. A proteína, que está localizado na membrana, contém um pequeno domínio extracelular e um grande domínio intracelular. Este último provavelmente desempenha um papel importante na ativação do canal. O domínio extracelular restringe o canal e funciona como filtro de seletividade. "Os resíduos positivos neste filtro atraem íons de cloreto carregados negativamente e permitem sua penetração, enquanto excluem moléculas maiores de entrar na célula, "explica Raimund Dutzler.
Com o trabalho deles, os cientistas do UZH forneceram uma base para uma melhor compreensão dos mecanismos moleculares subjacentes ao controle de volume celular. "Este conhecimento fornece uma base valiosa para o desenvolvimento de novos medicamentos em potencial, "diz Dutzler. Em caso de isquemia cerebral ou acidente vascular cerebral, os astrócitos do cérebro incham. A saída descontrolada resultante do neurotransmissor glutamato, que é mediado por VRACs, tem consequências prejudiciais para as pessoas afetadas. Esses casos podem se beneficiar do desenvolvimento de bloqueadores específicos. Outra aplicação potencial refere-se ao papel dos VRACs na terapia do câncer:uma ativação específica de células de VRACs pode melhorar a absorção da terapêutica nas células cancerosas.