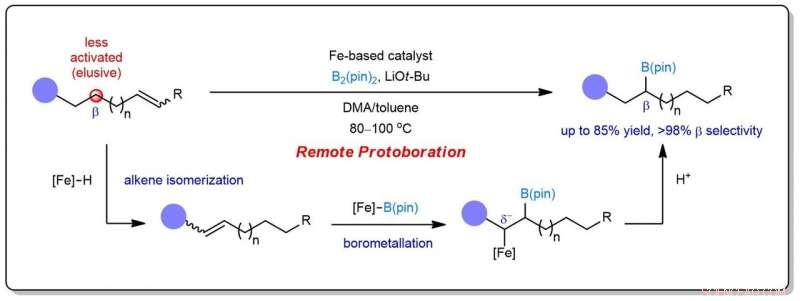
Figura 1:Esquema que mostra o projeto de protoboração remota para atingir a borilação seletiva em posições β menos ativadas. Crédito:Universidade Nacional de Cingapura
Os químicos da National University of Singapore descobriram uma maneira de obter a borilação seletiva de alcenos usando catalisadores à base de ferro em abundância para facilitar a síntese de produtos químicos de alto valor.
Devido aos seus inúmeros atributos desejáveis, moléculas contendo boro desempenham um papel fundamental na descoberta de medicamentos e servem como precursores indispensáveis para diversos produtos químicos, desde produtos farmacêuticos a materiais poliméricos. Nesse contexto, uma abordagem atraente para acessar compostos de organoboro alifáticos envolve hidroboração catalítica ou protoboração de ligações duplas carbono-carbono (C-C), reações nas quais hidrogênio e boro são ambos adicionados a um alceno. Uma variação moderna deste processo envolve a borilação remota, em que o boro é inserido distante do sítio reativo inicial. Contudo, os métodos existentes muitas vezes levam a borilações no terminal ou em posições ativadas geminal (α) para unidades funcionais. Instalar o cobiçado grupo boryl em posições não ativadas é um desafio formidável.
Uma equipe de pesquisa liderada pelo Prof KOH Ming Joo, do Departamento de Química, A NUS desenvolveu uma nova transformação catalítica conhecida como protoboração remota. Neste sistema, um único complexo à base de ferro promove a isomerização do alceno seguida pela adição de protoboril seletiva ao local à ligação C =C. Assim, o boro pode ser instalado em posições tipicamente menos ativadas vicinais (β) para grupos funcionais comuns. O protocolo tem escopo significativo e utilidade na síntese de compostos medicamente relevantes.
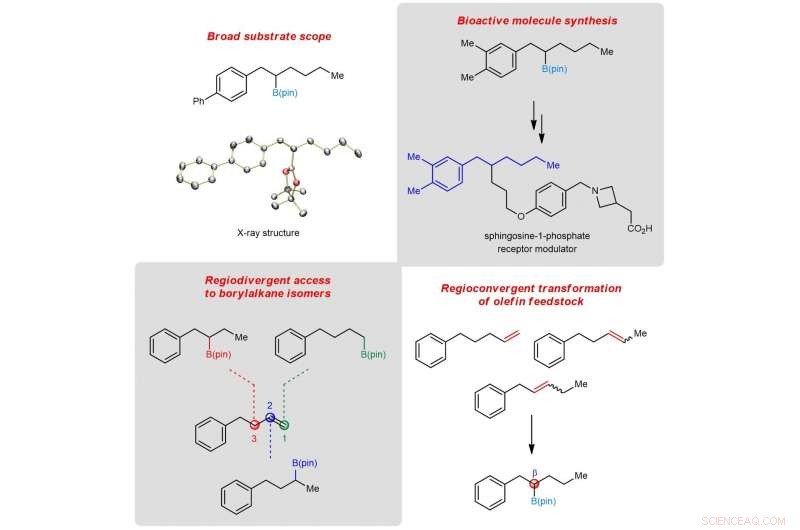
Figura 2:Esquema mostrando a utilidade da borilação β-seletiva em síntese química e reações convergentes e divergentes regiosseletivas. Crédito:Universidade Nacional de Cingapura
Estudos mecanísticos detalhados revelaram que o sucesso da protoboração remota reside na geração in situ de duas espécies de organo-ferro catalíticas (hidreto de ferro e boril de ferro) que operam em sinergia. Aproveitando esses insights, a equipe demonstrou que as misturas de regioisômeros de alceno (em matéria-prima química não refinada) podem ser convertidas em um único produto, e o acesso seletivo a regioisômeros de borilalcano de um substrato de alceno pode ser realizado.
Prof Koh disse, "Os dois intermediários catalíticos organo-ferro possuem perfis de reatividade diferentes, permitindo que eles coexistam e reajam de forma seletiva. Um fator chave de controle é a quantidade de fonte de prótons presente, gerado acidentalmente in situ ou adicionado exogenamente à mistura de reação. Isso ajuda a ajustar as taxas relativas de isomerização e protoboração do alqueno. "
"Esta descoberta tem implicações tremendas além da protoboração remota. Se pudermos manipular com precisão a posição das mudanças de alceno e subsequente inserção do protoboril, podemos potencialmente instalar o boro em qualquer local desejado de uma molécula orgânica. Espera-se que os insights obtidos com nossos estudos avancem os esforços gerais em direção a esse objetivo final, "acrescentou o Prof Koh.
A equipe de pesquisa planeja aplicar os novos conceitos para enfrentar outros desafios relativos às funcionalizações seletivas de local de moléculas orgânicas para a síntese de compostos de interesse importantes.