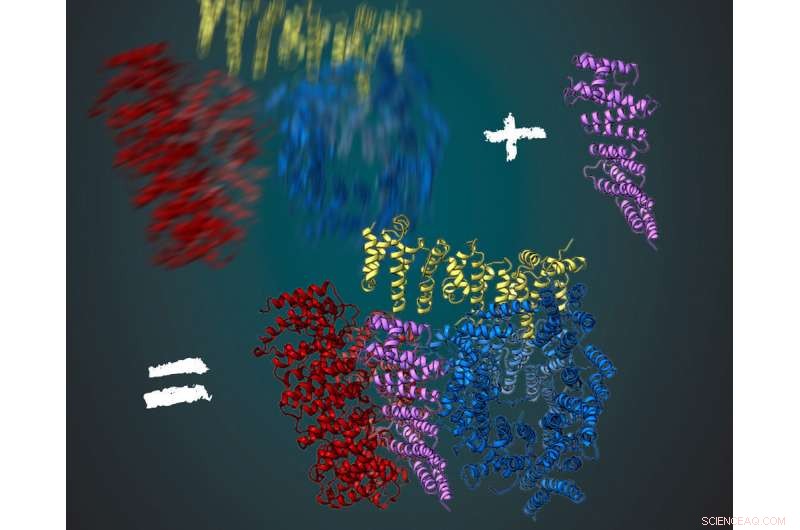
A proteína huntingtina consiste em três regiões flexíveis, mostrado em vermelho, amarelo e azul. Junto com seu parceiro de interação HAP40 (roxo), a huntingtina é mais estável. Isso permitiu aos cientistas deduzir sua estrutura tridimensional usando microscopia crioeletrônica. Crédito:MPI of Bioquímica / Ilustração:Gabriele Stautner, ARTIFOX
Mutações em um único gene, o gene huntingtin, são a causa da doença de Huntington. Eles levam a uma forma incorreta da proteína correspondente. Com a ajuda de pesquisadores de microscopia crioeletrônica do Instituto Max Planck de Bioquímica em Martinsried e da Universidade de Ulm, agora decodificaram o formato tridimensional, estrutura molecular da proteína huntingtina humana saudável. Isso agora permite sua análise funcional. Uma melhor compreensão da estrutura e função da proteína huntingtina pode contribuir para o desenvolvimento de novos métodos de tratamento no futuro.
A doença de Huntington geralmente começa com distúrbios emocionais e é caracterizada por movimentos musculares involuntários e perda da capacidade mental. Até hoje, a doença neurológica é uma das doenças hereditárias ainda incuráveis e fatais. A proteína HTT, também chamado de huntingtina, desempenha um papel central na doença de Huntington. Por 25 anos, sabe-se que as mutações do gene huntingtina, que é o projeto para a mesma proteína, causar a doença de Huntington.
Embora os pesquisadores tenham trabalhado nisso por muitos anos, ainda existem muitos obstáculos a superar. Agora Rubén Fernández-Busnadiego do Instituto Max Planck de Bioquímica e Stefan Kochanek, chefe do Departamento de Terapia Gênica do Hospital Universitário de Ulm, conseguiram decodificar o molecular, estrutura tridimensional da proteína huntingtina.
Stefan Kochanek e sua equipe trabalham na produção e purificação da huntingtina há muito tempo. O que tem impedido uma análise detalhada da proteína nas últimas décadas? Fernández-Busnadiego, um especialista em microscopia crioeletrônica, menciona dois fatores principais:"Em primeiro lugar, A microscopia crioeletrônica só foi otimizada nos últimos anos para observar estruturas de proteínas com resolução quase molecular. A segunda razão é que a proteína huntingtina é muito flexível em sua estrutura. Agora mesmo, encontramos também uma solução para este problema. "Durante a análise, fotos da proteína estão sendo tiradas de diferentes perspectivas sob o microscópio. A estrutura molecular tridimensional pode ser calculada a partir do grande número de imagens resultantes. Por esta, a proteína deve estar sempre na mesma conformação. Fernández-Busnadiego explica:"Isso seria semelhante a uma pessoa sendo fotografada no escuro. Se a pessoa não ficar parada por um tempo, a foto ficará embaçada. "
Para obter uma imagem clara, os pesquisadores do laboratório Kochanek têm procurado outras proteínas que interagem com a huntingtina e a estabilizam. Isso funcionou para a proteína HAP40. "A Huntingtina em conexão com o HAP40 é estabilizada em uma conformação particular. Assim, média de muitas fotos, fomos capazes de derivar a estrutura tridimensional, "disse Kochanek." Se permanecermos na analogia da foto no escuro, então, a proteína atua como uma cadeira para a pessoa fotografada. Sentado nele, a pessoa se move muito menos e a imagem fica muito mais nítida com o mesmo tempo de exposição, "acrescenta Fernández-Busnadiego.
"Embora já soubéssemos há algum tempo que a mutação do gene huntingtina tem consequências graves, ainda sabemos relativamente pouco sobre a função e as tarefas da proteína saudável, "explica Kochanek. As proteínas são as máquinas moleculares da célula. Para cumprir suas tarefas versáteis, eles têm uma certa estrutura tridimensional, semelhante a um componente específico em uma máquina. "Agora que sabemos a estrutura exata da huntingtina, podemos estudar mais quais áreas da huntingtina são particularmente importantes e como outras proteínas cooperam funcionalmente com a huntingtina. Desta forma, as estruturas podem ser deduzidas para serem alvejadas terapeuticamente por certas drogas. "
Agora mesmo, há muita coisa acontecendo na pesquisa da doença de Huntington. Grande esperança é direcionada a um método, que silencia o gene da huntingtina com os chamados oligonucleótidos anti-sentido para o tratamento da doença de Huntington. Essas pequenas moléculas reduzem a formação de proteínas huntingtina nas células, mas a droga não pode diferenciar entre a proteína huntingtina normal e a patologicamente alterada. Também por este motivo, é importante aprender mais sobre a função da proteína huntingtina saudável. Kochanek olha com confiança para o futuro:"A estrutura decodificada nos trará um grande passo à frente".
"Os testes de tratamento com oligonucleotídeos antisense são atualmente realizados apenas em poucas clínicas. A Neurological University Clinic Ulm lidera o teste de drogas para a Alemanha. Alguns dos oligonucleotídeos antisense atualmente revisados reduzem a formação da proteína huntingtina normal e mutante, enquanto outros buscam predominantemente reduzir a huntingtina alterada. Atualmente não está claro se uma inibição parcial da formação da proteína huntingtina normal tem desvantagens e é tolerada sem efeitos colaterais indesejáveis. Esta é outra razão pela qual é importante aprender mais sobre a função normal da proteína huntingtina. Para este fim, o estudo dará uma contribuição importante, "diz Bernhard Landwehrmeyer, o Diretor do Ambulatório de Huntington do Departamento de Neurologia da University Medical Center Ulm.