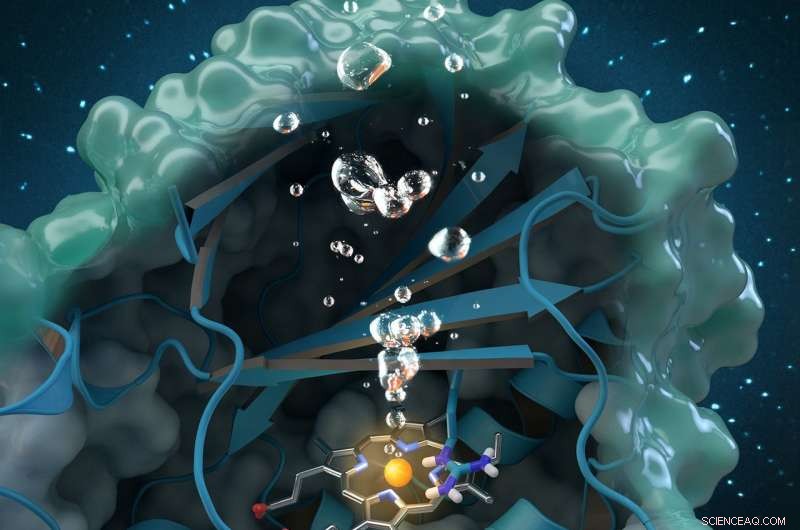
A clorito dismutase é uma enzima única geradora de oxigênio que degrada o clorito, um poluente industrial encontrado globalmente nas águas subterrâneas, água potável e solos. A pesquisa realizada no ORNL contribui para uma análise estrutural e bioquímica abrangente da enzima, pavimentando o caminho para futuras aplicações ambientais. Crédito:Arte da capa do jornal reimpressa com permissão de Catálise ACS , vol. 7, edição 11, 3 de novembro, 2017
Um novo estudo lança luz sobre uma enzima única que pode fornecer um tratamento ecológico para fontes de água contaminada com clorito e melhorar a qualidade da água em todo o mundo.
Uma equipe internacional de pesquisadores liderada por Christian Obinger da Universidade de Viena usou a análise de nêutrons no Oak Ridge National Laboratory, cristalografia de raios-x e outras técnicas para estudar a enzima clorito dismutase. Esta proteína que ocorre naturalmente pode quebrar o clorito, um poluente industrial encontrado nas águas subterrâneas, água potável e solo, em subprodutos inofensivos, mas seu processo catalítico não é bem compreendido. Compreender como a enzima bacteriana converte clorito em cloreto e oxigênio pode abrir possibilidades para futuras aplicações em biorremediação e biotecnologia.
Os resultados, publicado em Catálise ACS , também contribuem para pesquisas fundamentais sobre a capacidade da enzima de produzir oxigênio. A geração de oxigênio é incrivelmente rara na natureza, antes pensado ser possível apenas por fotossíntese, portanto, a atividade enzimática da clorito dismutase atraiu o interesse da comunidade científica além de suas aplicações ambientais para água limpa.
Exatamente como a clorito dismutase funciona em nível molecular para quebrar o clorito tem sido debatido desde a descoberta da enzima em 1996. A complexidade da estrutura molecular da enzima e a dificuldade de estudar proteínas com métodos experimentais apresentam desafios inerentes aos pesquisadores.
Como a maioria das enzimas, a clorito dismutase é uma proteína que catalisa uma reação altamente específica. O processo costuma ser dependente do ambiente, o que significa que funciona melhor dentro de parâmetros específicos, incluindo temperatura, concentração e faixas de pH. Identificar os parâmetros ideais para a reação é a chave para apoiar a bioengenharia e a produção em grande escala de clorito dismutase para remover com segurança o clorito do ambiente e potencialmente explorar a geração de oxigênio da enzima.
A equipe isolou uma cepa Cyanothece não estudada de clorito dismutase e examinou a estrutura cristalina da proteína em valores de pH específicos para determinar o impacto do pH na conversão de clorito.
Os pesquisadores usaram MaNDi, o difratômetro macromolecular de nêutrons, linha de luz 11-B na Fonte de Nêutrons de Espalação, um Departamento de Instalações do Usuário de Energia em ORNL, para coletar dados únicos que só podem ser obtidos por meio do uso de nêutrons.
"Diferentes cristais de proteína têm diferentes graus de simetria, que determinará como procederemos para medi-los. Este cristal é incomum por ter muito pouca simetria, portanto, um número especialmente grande de reflexões deve ser registrado individualmente para obter um conjunto de dados completo, "disse Leighton Coates, MaNDi Lead Instrument Scientist. "Seria uma tarefa desafiadora e demorada em qualquer lugar, e isso só foi possível neste período de tempo devido à grande cobertura do detector de área do instrumento MaNDi. "
No MaNDi, os pesquisadores foram capazes de detectar os estados de protonação de aminoácidos importantes que se acredita apoiarem a reação. "Protonação" refere-se a uma etapa fundamental na catálise durante a qual o hidrogênio se liga às moléculas. “Esta é a região importante da proteína, onde a química está acontecendo e o clorito está sendo decomposto, "disse Coates.
Os estados de protonação não são facilmente observados porque envolvem hidrogênio, o que é difícil de detectar com raios-x ou outras técnicas. Além disso, um fenômeno denominado "fotredução" ocorre ao expor enzimas contendo metal, como clorito dismutase, a raios-x, essencialmente mudando a estrutura atômica da amostra.
Como as técnicas de nêutrons não têm essas limitações, eles podem fornecer aos pesquisadores informações importantes que não podem ser obtidas por outros métodos. "Os nêutrons são não destrutivos e sensíveis a elementos leves como o hidrogênio, para que possam fornecer informações exclusivas sobre a estrutura atômica das proteínas, que são amplamente compostos por moléculas de hidrogênio, "Coates explicou.
"E ao contrário dos raios-x que podem danificar proteínas delicadas, técnicas de nêutrons permitem coletar dados em temperatura ambiente em uma proteína inalterada em seu estado ativo, sem os impactos da radiação ionizante e fotredução, "disse Coates." Este experimento realmente destaca o benefício de usar nêutrons para estudar proteínas. "