Pesquisa publicada recentemente em Nature Communications examina as capacidades de uma proteína humana que inibe o HIV-1, APOBEC3G (A3G). O artigo destaca o trabalho do professor e presidente de física do nordeste, Mark Williams, pesquisador de pós-doutorado Mike Morse, Professora Linda Chelico, Universidade de Saskatchewan no Canadá, e Ioulia Rouzina, Universidade Estadual de Ohio. Crédito:Mike Morse / Northeastern University
Quinze anos atrás, uma classe de proteínas foi descoberta, que dão aos humanos imunidade inata ao HIV-1. Infelizmente, O HIV-1 é um vírus inteligente e evoluiu para combater essas proteínas. Pesquisadores nordestinos, com a ajuda de seus colaboradores, têm estudado essas proteínas por vários anos para ajudar a entender melhor sua função e mecanismos na esperança de estarem melhor preparados contra o HIV-1.
A pesquisa, publicado em Nature Communications , destaca o trabalho do professor e presidente de física do nordeste Mark Williams, pesquisador de pós-doutorado Mike Morse, Professora Linda Chelico, Universidade de Saskatchewan no Canadá, e Ioulia Rouzina, Universidade Estadual de Ohio. O artigo examina as capacidades de uma proteína humana que inibe o HIV-1, APOBEC3G (A3G).
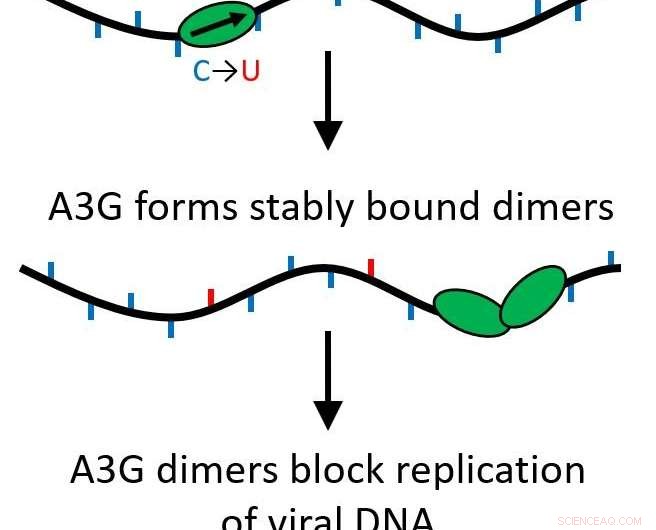
Suas descobertas determinaram que quando a proteína A3G cresce de uma única proteína (monômero) para um complexo de duas proteínas (dímero), sua função é transformada de uma proteína editora que muda o DNA viral para atuar como um obstáculo para a replicação posterior do vírus.
"Fiquei completamente surpreso com o resultado de que os dímeros eram suficientes para fazer isso, "disse Williams." Recebemos nossos dados, e os dados nos disseram isso, mas levou muito tempo para perceber que a única maneira de entender esses dados é que os dímeros devem ser o modelo para que as propriedades da proteína mudem repentinamente. "
O Laboratório Williams de Biofísica de Molécula Única é especializado em instrumentos chamados pinças ópticas que estudam moléculas como moléculas de DNA simples ou complexos DNA-proteína. Esta ferramenta mantém DNA ou RNA entre duas esferas de poliestireno para observar as interações com o DNA, observando as mudanças em seu comprimento e tensão. Usando esta técnica, o laboratório estuda muitos sistemas biológicos diferentes, incluindo a replicação do HIV-1. Uma combinação desses métodos biofísicos com os experimentos de atividade enzimática e criação de formas mutantes de A3G pelo laboratório Chelico permitiu a Williams e Morse comparar a forma original da proteína com diferentes mutantes contendo mudanças estruturais. Isso permitiu o isolamento do processo que resultou em proteína dimerizada ligada de forma estável.
Nos últimos 12 anos, o laboratório Williams tem estudado a replicação do HIV-1 com a ajuda de uma bolsa do NIH. Seu projeto mais recente envolve a compreensão das proteínas imunes inatas que dão imunidade aos humanos contra o HIV-1. Existem sete proteínas na família APOBEC3, alguns dos quais lutam contra retrovírus como o HIV-1, enquanto outros lutam contra retrotransposons, que são elementos genéticos que se amplificam dentro de um genoma e têm potencial para causar doenças.
Todas as proteínas APOBEC são citidina desaminases, permitindo que eles modifiquem o DNA de fita simples para substituir as bases, causando mutações quando a fita é replicada. Contudo, A3G também tem outra função que faz exatamente o oposto. Em vez de passar rapidamente pelo genoma fazendo edições, pode se tornar uma proteína de ligação estável que inibe a ocorrência do processo de transcrição reversa, prevenir a replicação do HIV-1. Isso acontece por causa de um processo chamado oligomerização, onde unidades de proteína única (monômeros) se unem para criar complexos ou oligômeros de multiproteínas.
"A ideia de que você poderia ampliar e fazer essas mudanças, e ainda estar bloqueando outra coisa de se mover, realmente não fazia sentido, "disse Williams." É por isso que a oligomerização é tão importante. À medida que eles começam rápido e seguem em frente, com o tempo, eles oligomerizam e se tornam muito lentos. "
Esta equipe de pesquisadores descobriu a oligomerização conforme publicado em seu artigo de 2014 em Química da Natureza . O estudo mostrou que o crescimento de um complexo multiproteico fez com que a proteína diminuísse, mas não se sabia quantas proteínas eram necessárias para formar um complexo lento. Se o número fosse alto, os resultados podem não ser relevantes para a replicação viral. Além disso, eles poderiam mostrar que os complexos eram lentos, mas não sabiam dizer se os complexos lentos tinham atividade enzimática. Mas agora sua nova pesquisa encontrou as respostas para essas duas questões críticas.
"Entre nossos experimentos, onde observamos diretamente a ligação de proteínas ao DNA, e o trabalho do Professor Chelico investigando a atividade enzimática do A3G, descobrimos que em escalas de tempo curtas na forma monomérica, a proteína se liga e se dissocia muito rapidamente do DNA e tem alta atividade enzimática, "disse Morse." Mas uma vez que você o deixa formar esses oligômeros, a ligação é muito mais estável, e não se dissocia tão facilmente. O professor Chelico foi capaz de descobrir que a atividade enzimática na verdade diminui quando esse processo ocorre, então você tem essas duas funções - a atividade enzimática que ocorre em uma escala única, e em uma forma, e esta função secundária que, devido à oligomerização, ocorre em outra escala de tempo. "
A pesquisa mostrou que isso acontece mesmo que apenas duas proteínas se juntem, formando um dímero. O dímero é suficiente para tornar o complexo proteico estável e alterar a função da proteína. Uma vez que apenas um dímero é necessário, vários roadblocks podem estar agindo para evitar que a transcrição reversa ocorra. Agora, esta função importante tem mais probabilidade de ser biologicamente relevante.
"Saber como algo inibe o HIV-1 pode ser um guia para ajudar a projetar novos métodos para medicamentos anti-HIV. O vírus HIV-1 desenvolveu sua própria proteína para induzir a célula a degradar as proteínas APOBEC, então, se pudermos descobrir como parar essa degradação, talvez pudéssemos aumentar a capacidade desta proteína de inibir o HIV-1, "Williams disse.
O Williams Lab da Northeastern University planeja continuar a estudar as diferentes proteínas APOBEC, outros inibem o HIV-1 ou retrotransposons. Através do estudo dessas proteínas com suas ferramentas únicas de medição biofísica, seu laboratório espera entender a regulação das proteínas, atividade, e processos para nos ajudar a estar mais preparados contra o HIV e outras doenças relacionadas.