Os dois finalmente se encontram:nanofios e nanotubos combinados para formar sondas bioeletrônicas intracelulares
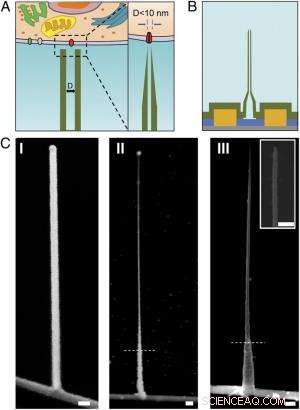 p Esquemas e imagens SEM do ultrasmall BIT-FET. ( UMA ) Ilustração esquemática de uma sonda bioeletrônica intracelular. ( Deixou ) Esquema geral de uma sonda para registro de eletrofisiologia intracelular. ( Direito ) Uma visão ampliada da ponta de uma sonda bioeletrônica sub-10 nm e seu tamanho relacionado ao canal de íon único. ( B ) Estrutura esquemática do ultrasmall BIT-FET. Verde, amarelo, azul, e as cores cinza representam SiO 2 camada, contato de metal, SiNW, e substrato de nitreto de silício, respectivamente. ( C ) Imagens SEM do BITFET ultrapequeno em diferentes etapas de fabricação. Um ramo GeNW foi primeiro cultivado no topo de SiNW ( eu ), seguido por um H subsequente 2 O 2 decapagem da parte superior de GeNW para diminuir seu diâmetro para um regime de sub-10 nm ( II ) Uma visão final de um BIT-FET ultrapequeno com nanotubo ID ∼8 nm, e SiO 2 espessura da parede ∼10 nm é apresentada em ( III ) Inserção de III é o close da ponta do ultrasmall SiO 2 nanotubo. Linhas tracejadas brancas em II e III indicam o ponto abaixo do qual o GeNW e SiO 2 é protegido por fotorresiste durante H 2 O 2 e gravação BHF, respectivamente. Todas as barras de escala:100 nm. Crédito:Copyright © PNAS, doi:10.1073 / pnas.1323389111
p Esquemas e imagens SEM do ultrasmall BIT-FET. ( UMA ) Ilustração esquemática de uma sonda bioeletrônica intracelular. ( Deixou ) Esquema geral de uma sonda para registro de eletrofisiologia intracelular. ( Direito ) Uma visão ampliada da ponta de uma sonda bioeletrônica sub-10 nm e seu tamanho relacionado ao canal de íon único. ( B ) Estrutura esquemática do ultrasmall BIT-FET. Verde, amarelo, azul, e as cores cinza representam SiO 2 camada, contato de metal, SiNW, e substrato de nitreto de silício, respectivamente. ( C ) Imagens SEM do BITFET ultrapequeno em diferentes etapas de fabricação. Um ramo GeNW foi primeiro cultivado no topo de SiNW ( eu ), seguido por um H subsequente 2 O 2 decapagem da parte superior de GeNW para diminuir seu diâmetro para um regime de sub-10 nm ( II ) Uma visão final de um BIT-FET ultrapequeno com nanotubo ID ∼8 nm, e SiO 2 espessura da parede ∼10 nm é apresentada em ( III ) Inserção de III é o close da ponta do ultrasmall SiO 2 nanotubo. Linhas tracejadas brancas em II e III indicam o ponto abaixo do qual o GeNW e SiO 2 é protegido por fotorresiste durante H 2 O 2 e gravação BHF, respectivamente. Todas as barras de escala:100 nm. Crédito:Copyright © PNAS, doi:10.1073 / pnas.1323389111
p (Phys.org) - Sondas bioeletrônicas miniaturizadas transformam a biologia e a medicina, permitindo a medição de componentes intracelulares
na Vivo . Recentemente, cientistas da Universidade de Harvard e da Universidade de Pequim projetaram, fabricou e demonstrou sondas bioeletrônicas tão pequenas quanto 5 nanômetros usando uma única heteroestrutura nanofio-nanotubo de três dimensões. (Uma heteroestrutura combina múltiplas heterojunções - interfaces entre duas camadas ou regiões de semicondutores cristalinos dissimilares - em um único dispositivo.) Por meio de medições experimentais e simulações numéricas, os pesquisadores mostraram que esses dispositivos têm resolução de tempo suficiente para registrar os sinais elétricos mais rápidos em neurônios e outras células, com integração em matrizes de chips maiores, potencialmente fornecendo mapeamento de ultra-alta resolução da atividade em redes neurais e outros sistemas biocelulares. p O prof. Xiaojie Duan discutiu o artigo que ela, Pesquisador Graduado Tian-Ming Fu, Prof. Charles M. Lieber e seus co-autores publicados em
Proceedings of the National Academy of Sciences . Ela primeiro aponta que as sondas de nanotubos e sua heterojunção com transistores de efeito de campo de nanofios de silício (SiNW FETs) tornam-se mecanicamente menos estáveis à medida que o diâmetro é reduzido. "Quando o nanotubo fica cada vez menor, "Duan disse ao Phys.org, "fica mais fácil quebrar o nanotubo na área de junção com o SiNW. Na aplicação do uso da sonda para detecção bioeletrônica intracelular, haverá várias forças, como a força capilar do líquido, bem como a interação entre a sonda e a membrana celular. Essas forças podem quebrar a sonda se houver uma junção fraca entre ela e o SiNW. "
p Outro problema é que a sensibilidade elétrica também é reduzida à medida que o diâmetro do nanotubo diminui, porque o diâmetro interno do nanotubo (ID) define a área efetiva da porta do dispositivo. "No registro do potencial transmembrana intracelular usando nossa sonda, "Duan explica, "citosol preenche o nanotubo e atua como o eletrodo de porta para o SiNW FET subjacente."
Citosol (também denominado
fluido intracelular ou
matriz citoplasmática ) é o líquido encontrado dentro das células, excluindo organelas e outros componentes citoplasmáticos. "A alteração do potencial do citosol modula a densidade de portadores do SiNW FET, alterando assim sua condutância, "Duan continua." É assim que nossa sonda funciona para o registro bioeletrônico. "A área de contato entre o citosol e o SiNW - definida pelo diâmetro interno do nanotubo - determina a eficácia da modulação da condutância. Em outras palavras, se o diâmetro interno do nanotubo for muito pequeno, a área do portão SiNW FET também será muito pequena.
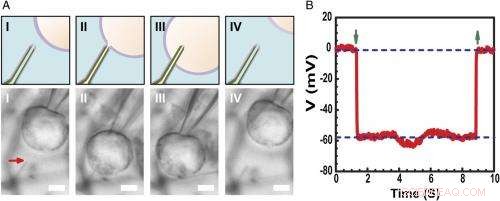 p Registro do potencial da membrana em repouso intracelular. ( UMA ) Esquemas (superior) e imagens de microscopia óptica de contraste de interferência diferencial ( Diminuir ) de uma célula HL-1 manipulada por uma micropipeta de vidro para se aproximar ( eu ), contato ( II ), penetrar ( III ), e retrair ( 4 ) a partir de uma sonda BITFET ultrapequena modificada por fosfolipídios. A seta vermelha indica a posição da ponta ultrapequena do nanotubo. Porque SiO puro 2 nanotubo é opticamente transparente, o modelo GeNW deste dispositivo não foi gravado para geração de imagens. Barra de escala:2 μm. ( B ) Resultados de gravação elétrica representativos de um dispositivo BIT-FET ultrasmall ID de ∼10 nm; nesse caso, o GeNW foi gravado para render o ultrasmall SiO 2 nanotubo. Setas verdes apontando para baixo e para cima marcam o início da penetração e retirada das células, respectivamente. As linhas tracejadas horizontais superiores e inferiores indicam os potenciais extracelulares e intracelulares. As medições quase estáticas da porta de água feitas antes / depois das medições das células mostram uma mudança <2% na condutância e sensibilidade do dispositivo. Crédito:Copyright © PNAS, doi:10.1073 / pnas.1323389111
p Registro do potencial da membrana em repouso intracelular. ( UMA ) Esquemas (superior) e imagens de microscopia óptica de contraste de interferência diferencial ( Diminuir ) de uma célula HL-1 manipulada por uma micropipeta de vidro para se aproximar ( eu ), contato ( II ), penetrar ( III ), e retrair ( 4 ) a partir de uma sonda BITFET ultrapequena modificada por fosfolipídios. A seta vermelha indica a posição da ponta ultrapequena do nanotubo. Porque SiO puro 2 nanotubo é opticamente transparente, o modelo GeNW deste dispositivo não foi gravado para geração de imagens. Barra de escala:2 μm. ( B ) Resultados de gravação elétrica representativos de um dispositivo BIT-FET ultrasmall ID de ∼10 nm; nesse caso, o GeNW foi gravado para render o ultrasmall SiO 2 nanotubo. Setas verdes apontando para baixo e para cima marcam o início da penetração e retirada das células, respectivamente. As linhas tracejadas horizontais superiores e inferiores indicam os potenciais extracelulares e intracelulares. As medições quase estáticas da porta de água feitas antes / depois das medições das células mostram uma mudança <2% na condutância e sensibilidade do dispositivo. Crédito:Copyright © PNAS, doi:10.1073 / pnas.1323389111
p Os pesquisadores também foram apresentados ao fato de que a resposta dinâmica de alta frequência pode degradar com a diminuição do diâmetro interno do nanotubo devido ao aumento da resistência da solução no nanotubo. "Quando o diâmetro interno do nanotubo diminui, "Duan explica, "a resistência da solução dentro do nanotubo aumentará, devido à diminuição da seção transversal do condutor da solução. "Além disso, a velocidade na qual o SiNW FET subjacente pode responder a um sinal é determinada pelo produto
RC da capacitância e da resistência do condutor da solução dentro do nanotubo - então, se o nanotubo está ficando menor, a resistência está ficando maior. Isso significa que o SiNW FET precisará de mais tempo para responder - e se a mudança de sinal for muito rápida, a sonda não será capaz de gravá-lo de forma confiável. "Isso é o que queremos dizer com 'a resposta dinâmica de alta frequência se degradará com a diminuição do diâmetro interno do nanotubo, 'Duan acrescenta, "Contudo, descobrimos que para a nossa sonda, mesmo se diminuirmos o diâmetro interno do nanotubo para tão pequeno quanto 5 nm, a sonda ainda é capaz de registrar fielmente um sinal de 3 kHz - uma largura de banda suficiente na maioria dos casos para registrar sinais neurais e cardíacos. "
p Os pesquisadores também foram confrontados com a necessidade de usar detectores de transistores de efeito de campo de nanofios semicondutores ativos para superar as limitações da redução do tamanho da sonda. "A palavra ativo 'é comparada à natureza' passiva 'da gravação com eletrodos de metal, " Duan points out. "For metal electrode recording, a portion of the transmembrane potential
V m will be dropped or lost at the electrode/electrolyte interface, so the signal recorded will be smaller than the real transmembrane potential." When the size of the metal electrode is reduced, the impedance value at the electrode/electrolyte will increase – and at some point, this impedance will get so large that the recorded signal will be obscured by noise. Contudo, for the FET recording, the cytosol potential change is reflected by the semiconductor channel conductance change, which is independent of the probe/electrolyte interface impedance. "Since decrease in probe size will therefore
não affect the signal amplitude, " Duan adds, "using the FET to sense potential is a very effective way to overcome the limitations of probe-size reduction."
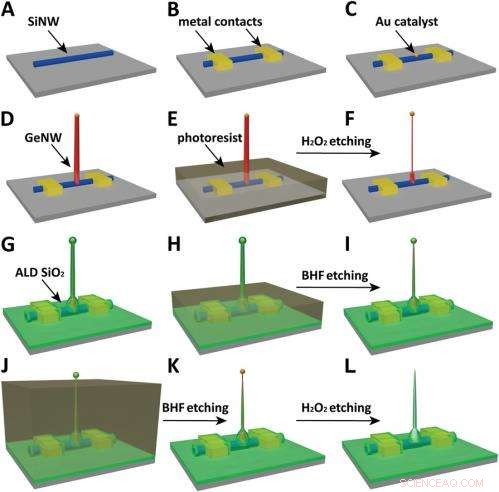 p Schematics of the fabrication flow for the ultrasmall BIT-FET. ( UMA ) SiNWs (blue) are dispersed on substrate (solid gray). ( B ) S/D contacts are defined by EBL followed by thermal evaporation. ( C ) Au nanodots are defined on SiNWs between S/D using EBL and thermal evaporation. ( D ) GeNWs (red) are grown on top of the SiNWs through nanocluster-catalyzed CVD process. ( E ) A thin layer of photoresist (transparent gray) is spin coated on the chip to protect the lower GeNW part. ( F ) The resulting H 2 O 2 -etched GeNWs following photoresist liftoff. Only the GeNW above the photoresist in E is thinned by etching in H 2 O 2 . (G) SiO 2 is conformally deposited over the entire chip by ALD. ( H ) A thin layer of photoresist (transparent gray) is spin coated to protect the lower region of chip. ( eu ) The resulting BHF etched structures following liftoff. The region of SiO 2 above the photoresist layer in H is etched to ca.10-nm thickness. ( J ) Photoresist with thickness smaller than the GeNW heights is deposited. ( K ) The resulting structure following BHF etching of SiO2, which exposes the tips of the GeNWs. Isotopic BHF etching yields a small taper with thinner SiO 2 at the topmost part of the structure. (L) The GeNW is removed by H 2 O 2 etching to form an ultrasmall nanotube connected to the bottom SiNW FET. Copyright © PNAS, doi:10.1073/pnas.1323389111
p Schematics of the fabrication flow for the ultrasmall BIT-FET. ( UMA ) SiNWs (blue) are dispersed on substrate (solid gray). ( B ) S/D contacts are defined by EBL followed by thermal evaporation. ( C ) Au nanodots are defined on SiNWs between S/D using EBL and thermal evaporation. ( D ) GeNWs (red) are grown on top of the SiNWs through nanocluster-catalyzed CVD process. ( E ) A thin layer of photoresist (transparent gray) is spin coated on the chip to protect the lower GeNW part. ( F ) The resulting H 2 O 2 -etched GeNWs following photoresist liftoff. Only the GeNW above the photoresist in E is thinned by etching in H 2 O 2 . (G) SiO 2 is conformally deposited over the entire chip by ALD. ( H ) A thin layer of photoresist (transparent gray) is spin coated to protect the lower region of chip. ( eu ) The resulting BHF etched structures following liftoff. The region of SiO 2 above the photoresist layer in H is etched to ca.10-nm thickness. ( J ) Photoresist with thickness smaller than the GeNW heights is deposited. ( K ) The resulting structure following BHF etching of SiO2, which exposes the tips of the GeNWs. Isotopic BHF etching yields a small taper with thinner SiO 2 at the topmost part of the structure. (L) The GeNW is removed by H 2 O 2 etching to form an ultrasmall nanotube connected to the bottom SiNW FET. Copyright © PNAS, doi:10.1073/pnas.1323389111
p Another critical challenge was synthetically integrating nanotubes and nanowires. "The nanotube is made of silicon oxide and the nanowire is made of silicon, " Du an notes. "For cell recording, the nanotube needs to be built vertically onto the nanowires – meaning that a three-dimensional heterostructure is needed." While the heterostructure could be fabricated in various ways, not all of them provided the required controllability at the probe scale. Portanto, the researchers grew a germanium nanowire (GeNW) on top of the silicon nanowires, with the GeNW acting as a template for the nanotube. "Depositing SiO
2 on the GeNW/SiNW heterostructure, then selectively removing the core GeNW, resulted in the desired nanotube/SiNW structure, " notes Duan. "Using this method, the nanotube inner diameter can be controlled by the GeNW diameter, the outer diameter can be controlled by the SiO
2 thickness, and the nanotube length can be defined by the GeNW growth time. This gives us complete and easily implemented control over the probe's dimensions."
p Finalmente, the scientists had to investigate and model the bandwidth effect of phospholipid coatings, which are important for intracellular recording. "We use phospholipid coating to assist the nanotube probe to penetrate the cell membrane, " Duan notes. "Since the bandwidth of our probe is important for the probe to be able to record fast neural or cardiac signal, we need to make sure this phospholipid modification will not overly affect the bandwidth." Because the phospholipid layer will decrease the cross section of the solution conductor inside the nanotube, it impacts bandwidth in two ways by changing the capacitance and resistance of the solution inside the nanotube. (The phospholipid-modified probe bandwidth is easily determined by applying a fast artificial signal to the solution, and then recording how the conductance of the device changes over time. This provides the time the device needs to respond to this signal and thus the device's bandwidth.) "Therefore, " Duan explains, "if the nanotube is large, this thin phospholipid layer will not cause too much of a difference. Contudo, for our probe, the sub-10 nm nanotube size is almost the same scale as the lipid layer – so we have to carefully examine how it affects probe bandwidth, both experimentally and theoretically."
p The scientists addressed these myriad challenges in designing, fabricando, and demonstrating the probe with three key innovations. "The first is the use of FET as potential sensing element, which in principle enables us to overcome the size limit on the probe." Duan explains. "However, FETs have conventionally existed in a linear geometry with connections that preclude access to the inside of cells." The second innovation was the solution to this problem – namely, the design of a vertical SiO
2 nanotube on top of the nanoscale FET, which allowed them to introduce cytosol into the cell without having to insert the FET channel inside the cell, which would be more invasive. The third key is the design of a relatively large nanotube base with a much sharper nanotube tip, resulting in a sub-10 nm probe without sacrificing its mechanical strength and electrical sensitivity.
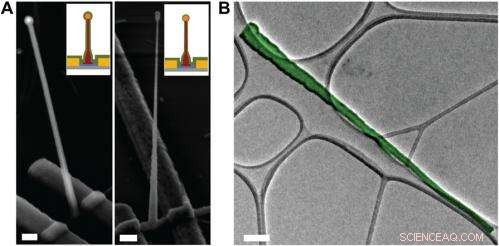 p Electron microscopy characterization of the ultrasmall BIT-FET. ( UMA ) Representative SEM (Zeiss Ultra Plus field-emission SEM) images of intermediate fabrication steps of the ultrasmall BIT-FET. ( Deixou ) Device after 30-nm ALD coating of SiO 2 . ( Direito ) Device after first step of selective BHF etching of the upper80% portion of the SiO 2 to ca. 10 nm (Fig. S1 H e eu ) White dashed lines in eu e II indicate the point below which the SiO 2 is protected by photoresist during BHF etching. Scale bars:200 nm. ( B ) False-colored transmission electron microscopy (JEOL 2100 TEM) image of an ultrasmall nanotube. This tube was fabricated following the same procedure as described in SI Text , and deposited onto lacey carbon grids (Ted Pella) from ethanol suspension. It has a tip ID ∼7 nm and bottom ID ∼80 nm. False color is used here to distinguish the SiO 2 nanotube from background amorphous carbon. Scale bar:50 nm. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
p Electron microscopy characterization of the ultrasmall BIT-FET. ( UMA ) Representative SEM (Zeiss Ultra Plus field-emission SEM) images of intermediate fabrication steps of the ultrasmall BIT-FET. ( Deixou ) Device after 30-nm ALD coating of SiO 2 . ( Direito ) Device after first step of selective BHF etching of the upper80% portion of the SiO 2 to ca. 10 nm (Fig. S1 H e eu ) White dashed lines in eu e II indicate the point below which the SiO 2 is protected by photoresist during BHF etching. Scale bars:200 nm. ( B ) False-colored transmission electron microscopy (JEOL 2100 TEM) image of an ultrasmall nanotube. This tube was fabricated following the same procedure as described in SI Text , and deposited onto lacey carbon grids (Ted Pella) from ethanol suspension. It has a tip ID ∼7 nm and bottom ID ∼80 nm. False color is used here to distinguish the SiO 2 nanotube from background amorphous carbon. Scale bar:50 nm. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
p An important aspect of the study was ensuring that the bioelectronic devices had sufficient time resolution to record the fastest electrical signals in neurons and other cells. "The signals in neural system are normally in the millisecond scale, " Duan points out. "That means that to reliably record these signals, the recording device needs to have a bandwidth measure in kilohertz." While the probe's bandwidth decreases with the decrease of nanotube diameter, the scientists found that even for probes with inner diameters as small as 5 nm, the bandwidth is still around 3 kHz (a time resolution ~ 0.3 ms) in physiological solution. "This means that our probes have sufficient time resolution to record the fastest electrical signals in neurons and other cells, " Duan adds.
p Além disso, Duan points out, the scientists found that measuring the cell transmembrane resting potential with these ultrasmall bioelectronic devices demonstrates the capability for intracellular electrophysiology studies. "When we measured the transmembrane resting potential of HL-1 cell with our new probes, we found that with the phospholipid modification, the nanotube can easily and reliably penetrate the cell membrane, allowing the FET to record the intracellular transmembrane potential at full amplitude." After retracting the nanotube from the cell, the recorded potential can immediately revert to the extracellular potential. "Reliable cell membrane penetration and stable recording of intracellular transmembrane potential prove the capability of our probes for intracellular electrophysiology studies, " notes Duan.
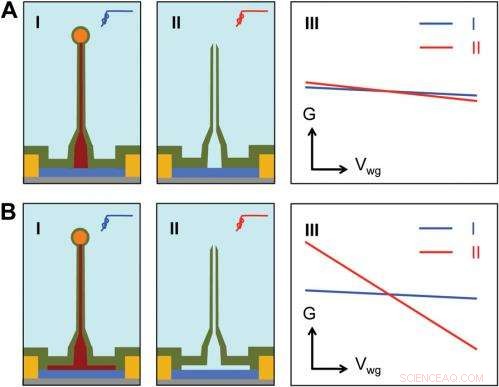 p Sensitivity of different device structures. ( UMA , B ) Schematics of the ultrasmall BIT-FET without and with Ge overcoating on the SiNW, respectivamente. eu e II correspond to the BIT-FET devices before and after Ge core etching. III show schematically typical conductance ( G ) vs. water-gate (V wg ) measurements from these distinct structures. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
p Sensitivity of different device structures. ( UMA , B ) Schematics of the ultrasmall BIT-FET without and with Ge overcoating on the SiNW, respectivamente. eu e II correspond to the BIT-FET devices before and after Ge core etching. III show schematically typical conductance ( G ) vs. water-gate (V wg ) measurements from these distinct structures. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
p Seguindo em frente, says Duan, the researchers' are planning to scale up their work to integrate the probes into high-density, large-scale array for large-scale mapping of neural activities; use the probes to record neural signals from small subcellular structures/organelles; and investigate other applications in which the probes will provide substantially greater spatial resolution and minimal invasiveness than other techniques.
p Além disso, the scientists might consider developing other innovations. "Por exemplo, " Duan illustrates, "a major challenge in using our ultra-small probes for recording from small subcellular structures is to accurately position them with respect to the subcellular structures of interest. We're looking at either labeling our probe with fluorescence dye – or other biocompatible materials – to mark the nanotube at high resolution, or using specific targeting in which the probe's biochemical surface groups define the specific cell location being studied."
p Duan sees other areas of research that might benefit from their study, Incluindo:
- Neuroscience:Since recording of intracellular action potential and other low frequency transmembrane potential signal is important to study the neural network.
- Medicine:By studying how the drugs affect the recorded intracellular action potentials or other transmembrane potentials, the probes can provide an attractive technique for parallel or high-throughput screening of drugs targeting the ion channels.
- Biophysics:The process of cell membrane penetration by the phospholipid-modified nanotube can serve as a useful platform for studying the cell membrane's fusion-related biological processes.
p © 2014 Phys.org. Todos os direitos reservados.




