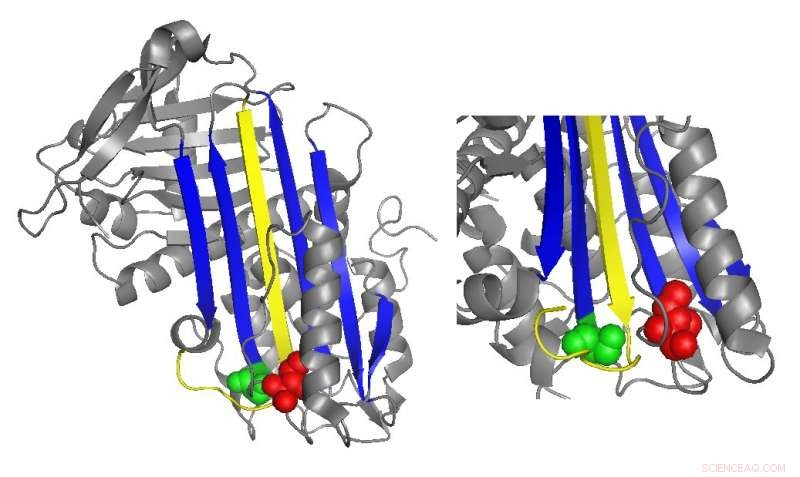
Um diagrama de fita de antitrombina destaca os locais de mutações funcionalmente importantes. Crédito:Irene Martinez-Martinez
Quando uma pessoa é ferida, a coagulação do sangue é essencial. Contudo, uma vez que o perigo passou, é igualmente essencial parar a resposta de coagulação, a fim de prevenir a trombose, ou a obstrução do fluxo sanguíneo por coágulos. Uma proteína chamada antitrombina é responsável por interromper a coagulação, mas cerca de uma em duas mil pessoas tem uma deficiência hereditária de antitrombina que as coloca em risco muito maior de coágulos sanguíneos com risco de vida.
Um grupo de pesquisadores na Espanha analisou as mutações nas proteínas antitrombina desses pacientes e descobriu que uma seção da proteína desempenha um papel inesperado em sua função. Essa percepção de como a antitrombina funciona pode levar a tratamentos não apenas para pacientes com deficiência de antitrombina, mas também para medicamentos mais bem elaborados para outras doenças do sangue. A pesquisa será publicada na edição de 6 de outubro do Journal of Biological Chemistry .
O Centro Regional de Hemodonacion e Hospital Universitario Morales Meseguer da Universidad de Murcia, na Espanha, é um centro de referência para o diagnóstico da deficiência de antitrombina. Por mais de 15 anos, pesquisadores do laboratório têm recebido amostras de pacientes com diversas mutações que afetam o funcionamento da antitrombina.
A antitrombina normalmente inibe a trombina inserindo uma região em forma de alça, chamado de loop central reativo, no sítio ativo da proteína trombina, impedindo a trombina de catalisar a formação de coágulos, distorcendo a forma do sítio ativo da trombina. Muitas mutações da antitrombina que causam doenças da coagulação afetam direta ou indiretamente a alça central reativa. Contudo, estudos bioquímicos conduzidos por Irene Martinez-Martinez descobriram que mutações em uma parte completamente diferente da antitrombina também contribuíram para sua disfunção.
"Vimos que tínhamos mutantes que afetavam a função da proteína, embora estivessem muito longe da parte principal da proteína responsável pela inibição, "Martinez-Martinez disse." As pessoas pensavam que a função da antitrombina estava focada principalmente em um domínio da proteína. Com este trabalho, percebemos que isso não é verdade. "
As análises dos pesquisadores das novas mutações sugeriram que o domínio da antitrombina na extremidade oposta da alça do centro reativo ajuda a manter a trombina presa em seu final, forma distorcida. Quando havia mutações específicas nesta região, a trombina foi mais frequentemente capaz de retornar à sua forma ativa e degradar e liberar a antitrombina.
Martinez-Martinez espera que a compreensão da importância desta região da antitrombina possa levar a melhores drogas para prevenir a coagulação do sangue, ativando a antitrombina, ou prevenir o sangramento, inibindo-a. Ela também enfatiza que a natureza essencial desse domínio da proteína não poderia ser prevista simplesmente pelo estudo das sequências de antitrombinas saudáveis.
“Este trabalho foi possível graças à caracterização das mutações identificadas nos pacientes, "Martinez-Martinez disse.
O trabalho foi financiado pelas fundações Instituto de Salud Carlos III e FEDER, bem como pela Fundación Séneca.