MenE catalisa uma reação em duas etapas em duas estruturas diferentes. Crédito:Departamento de Química, HKUST
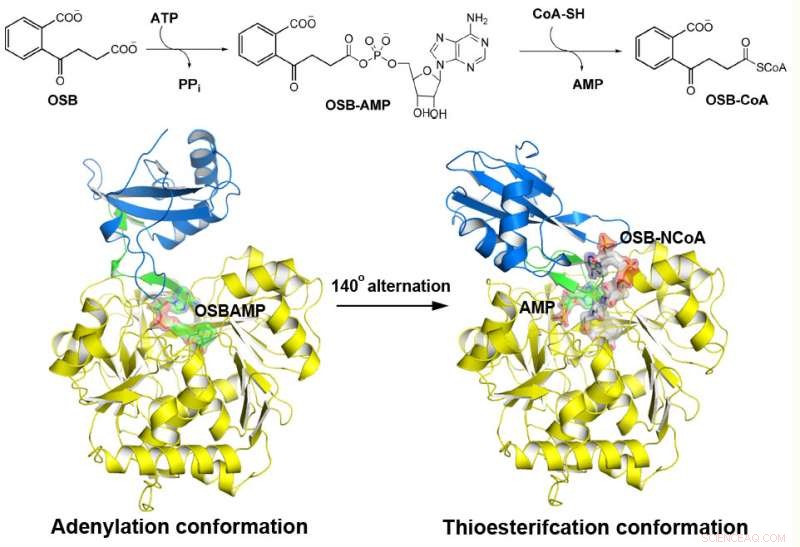
o-Succinilbenzoil-CoA (OSB-CoA) sintetase (MenE) é uma enzima essencial na biossíntese de vitamina K bacteriana e um alvo importante no desenvolvimento de novos antibióticos. É um membro da família de enzimas adenilantes (ANL), que reconfiguram seu sítio ativo em duas conformações ativas diferentes, um para a meia-reação de adenilação e o outro para uma meia-reação de tioesterificação, em um mecanismo catalítico de alternância de domínio. Embora vários aspectos do mecanismo de adenilação em MenE tenham sido recentemente descobertos, sua conformação de tioesterificação permanece indefinida.
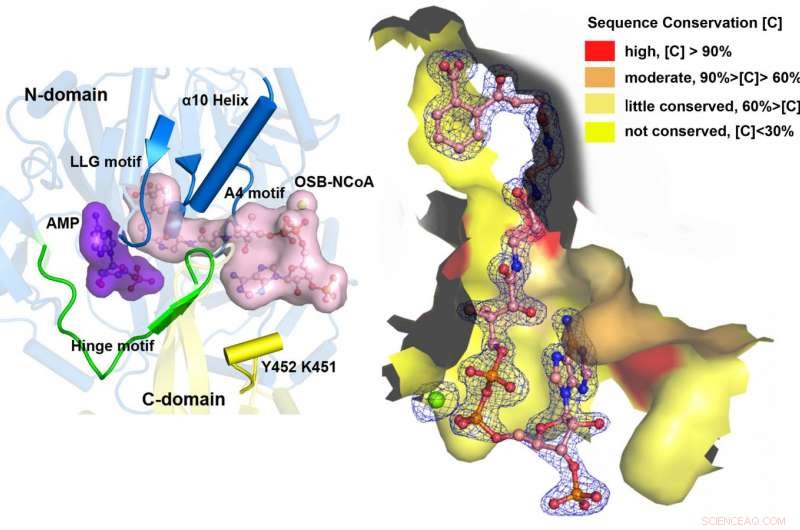
Usando uma proteína mutante de Bacillus subtilis cataliticamente competente complexada com um análogo OSB-CoA, pesquisadores da Universidade de Ciência e Tecnologia de Hong Kong revelaram um sítio ativo de tioesterificação especificamente conservado entre os ortólogos MenE e um modo de ligação ao substrato distinto daqueles de muitas outras sintetases acil / aril-CoA. Vários resíduos que contribuem especificamente para a meia-reação de tioesterificação sem afetar a meia-reação de adenilação foram identificados, e eles também observaram um movimento substancial do grupo succinil ativado na meia-reação de tioesterificação.
Suas descobertas foram publicadas no Journal of Biological Chemistry em 21 de julho, 2017
"Nossas descobertas fornecem novos insights sobre a catálise de alternância de domínio de uma enzima bacteriana essencial para a biossíntese de vitamina K, e de seus homólogos de adenilação na família de enzimas ANL, "disse Zhihong Guo, professor associado do Departamento de Química da HKUST. "Nosso trabalho validou a hipótese de que um modo distinto de ligação ao substrato é exclusivo para esta enzima."
MenE catalisa uma reação em duas etapas em duas estruturas diferentes. Crédito:Departamento de Química, HKUST
Como membro da família de enzimas ANL, A sintetase OSB-CoA (MenE) é um alvo valioso da droga na via biossintética da vitamina K, mas pouco se sabe sobre a estrutura da enzima ainda.
"Nós construímos estruturas de cristal de alta resolução de um mutante duplo cataliticamente competente (IRAK) de bsMenE em complexo com um análogo de produto estável, OSB-NCoA, e uma combinação de OSB-NCoA e AMP, "disse Guo." Além disso, essas estruturas cristalinas revelaram os resíduos de aminoácidos contribuindo para o reconhecimento e ligação dos substratos e produtos na reação de tioesterificação. Estes resultados não forneceram apenas suporte inequívoco para o mecanismo catalítico de alternância de domínio das enzimas ANL em geral; eles também revelaram o sítio ativo de tioesterificação único das sintetases OSB-CoA e forneceram a base estrutural para sua catálise da reação de tioesterificação para facilitar sua utilidade como um alvo de droga. "
"Nossas descobertas fornecem novas percepções sobre o mecanismo de alternância de domínio da enzima biossintética da vitamina K essencial e seus homólogos na família de enzimas ANL, e nos ajudará a construir um ciclo catalítico de proteínas de maneira contínua, que ninguém fez antes. "