
Eles desempenharam um papel fundamental na demonstração do comportamento incomum do carbono:Tim Schleif (à esquerda) e Joel Mieres Perez (à direita). Crédito:RUB, Marquard
Químicos da Ruhr-Universität Bochum encontraram evidências de que os átomos de carbono não se comportam apenas como partículas, mas também como ondas. Esta propriedade da mecânica quântica é bem conhecida por partículas de luz, como elétrons ou átomos de hidrogênio. Contudo, pesquisadores raramente observaram a dualidade onda-partícula para átomos pesados, como o carbono. A equipe liderada pelo Prof. Dr. Wolfram Sander e Tim Schleif da cadeira de Química Orgânica II juntamente com o Prof. Dr. Weston Thatcher Borden, University of North Texas, relatórios no jornal Angewandte Chemie .
"Nosso resultado é um dos poucos exemplos que mostram que os átomos de carbono podem exibir efeitos quânticos, "diz Sander. Especificamente, os pesquisadores observaram que os átomos de carbono podem criar um túnel. Assim, eles superam uma barreira energética, embora eles não possuam energia suficiente para fazer isso.
Raramente observado para partículas pesadas
Wolfram Sander explica o paradoxo:"É como se um tigre tivesse saído de sua jaula sem pular a cerca, o que é muito alto para ele. Mas ele ainda sai. "Isso só é possível se ele se comportar como uma onda, mas não se ele se comportar como uma partícula. A probabilidade de um objeto ser capaz de criar um túnel depende de sua massa. O fenômeno pode, por exemplo, ser observada muito mais facilmente para elétrons leves do que para átomos de carbono relativamente pesados.
Os pesquisadores investigaram a reação do túnel usando o rearranjo Cope, uma reação química conhecida há quase 80 anos. O material de partida para a reação, um composto de hidrocarboneto, é idêntico à molécula do produto. O mesmo composto químico existe antes e depois da reação. Contudo, as ligações entre os átomos de carbono mudam durante o processo.
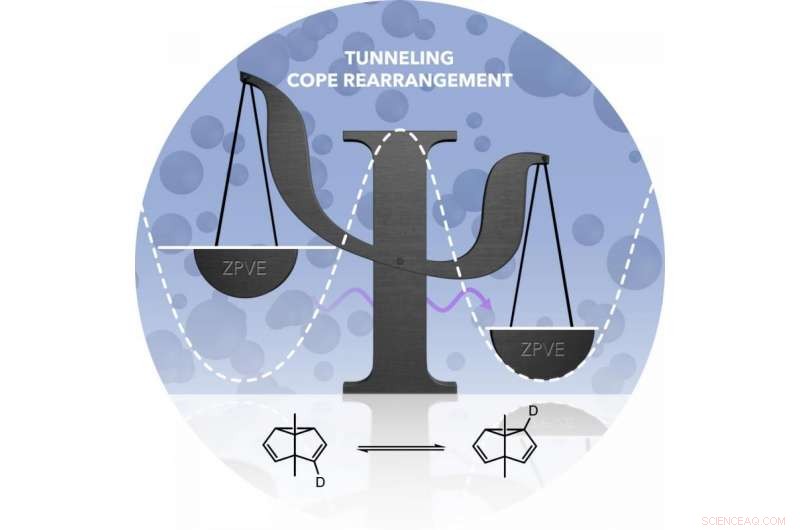
O rearranjo do Cope resulta em um produto que é idêntico ao material de partida. Contudo, ambas as formas têm energias diferentes. A barreira de energia para o rearranjo (simbolizada pela linha pontilhada) não pode ser superada em baixas temperaturas. Somente quando o átomo de carbono se comporta como uma onda (seta roxa), ele pode contornar a barreira. Crédito:Markus Henkel
Em seu experimento, os pesquisadores baseados em Bochum marcaram um dos átomos de carbono na molécula:eles substituíram o átomo de hidrogênio ligado a ele pelo isótopo de hidrogênio deutério, uma versão mais pesada do hidrogênio. As moléculas antes e depois do rearranjo de Cope diferiam em termos da distribuição do deutério. Devido a essas diferentes distribuições, ambas as formas moleculares tinham energias ligeiramente diferentes.
A reação não deveria realmente ocorrer
Em temperatura ambiente, essa diferença tem pouco efeito; devido ao abundante fornecimento de energia térmica na área circundante, ambas as formas ocorrem com igual freqüência. Contudo, a temperaturas muito baixas abaixo de dez Kelvin, uma forma de molécula é significativamente preferida devido à diferença de energia. Ao fazer a transição da temperatura ambiente para temperaturas extremamente baixas, o saldo deve passar de uma distribuição igual de ambas as formas para uma distribuição desigual.
Esta transição não pode, Contudo, ocorrem da maneira clássica - uma vez que, ao reorganizar de uma forma para a outra, uma barreira de energia deve ser superada, embora a própria molécula não tenha energia para isso e o ambiente frio também não seja capaz de fornecê-la. Embora o novo equilíbrio não deva ocorrer da maneira clássica, os pesquisadores, no entanto, foram capazes de demonstrá-lo no experimento. A conclusão deles:o rearranjo do Cope em temperaturas extremamente baixas só pode ser explicado por um efeito túnel. Eles, portanto, forneceram evidências experimentais para uma previsão feita por Weston Borden há mais de cinco anos, com base em estudos teóricos.
Os solventes influenciam a capacidade de tunelamento
Na Ruhr-Universität, Wolfram Sander realiza pesquisas no cluster de excelência Ruhr Explores Solvation, onde ele se preocupa com as interações de solventes e moléculas dissolvidas. “Sabe-se que os solventes influenciam a capacidade de tunelamento, "diz o químico." No entanto, até agora não foi entendido como eles fazem isso. "