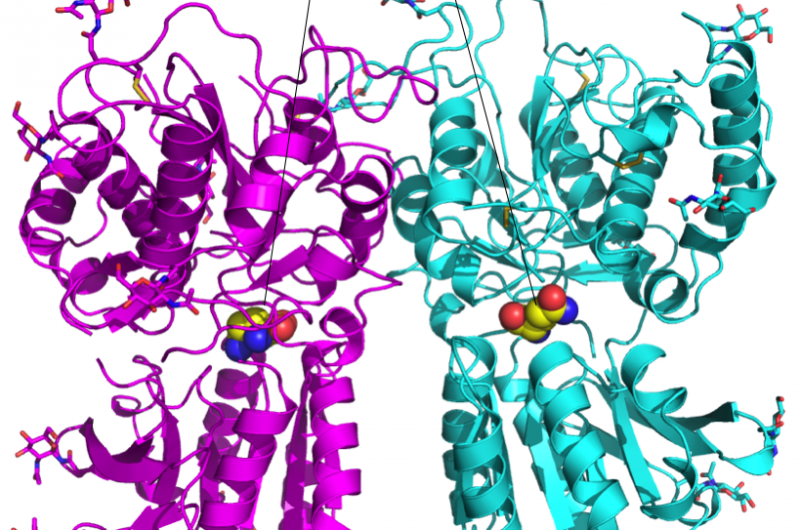
Figura 1:Estrutura cristalina do heterodímero do domínio de ligação ao ligante do receptor de sabor T1r2-T1r3. Crédito:Okayama University
Receptores são como o corpo sente seu ambiente. Após a ligação de um ligante, um receptor iniciará uma cadeia de eventos que elicia uma resposta. Nosso sistema olfativo depende de aproximadamente 400 receptores para nos dar o sentido do olfato. Gosto, Contudo, opera com um número muito menor:a combinação de apenas três membros da família do receptor de sabor tipo 1 (T1r) pode detectar uma ampla gama de sabores doces e salgados em humanos.
"Os heterodímeros T1r podem perceber a maioria das substâncias de sabor doce e umami, "diz o Prof. Junichi Takagi da Universidade de Osaka." Para entender essa percepção, examinamos a estrutura atômica do heterodímero. "
Nossos corpos sentem um sabor quando um aminoácido do alimento se liga a um heterodímero de dois membros T1r. Takagi é um especialista em biologia estrutural que estuda as conformações físicas dos receptores ao se ligarem a seus ligantes.
"A teoria do bloqueio e da chave explica a maioria das ligações ligante-receptor. T1r é incomum porque essa teoria não parece se aplicar. Achamos que seria um estudo de pesquisa interessante."
Takagi foi abordado pelo Prof. Atsuko Yamashita da Universidade de Okayama, que havia estudado o heterodímero T1r2-T1r3 do peixe medaka por anos. Este heterodímero se liga a uma ampla gama de aminoácidos para a percepção de sabores saborosos. Para medir a estrutura em nível atômico, eles usaram a experiência de Takagi, bem como o equipamento de radiação síncrotron da RIKEN SPring-8 no Japão.
A equipe de pesquisa descobriu que a estrutura do heterodímero era aproximadamente a mesma, independentemente da ligação do aminoácido, mas a afinidade com o aminoácido foi assegurada junto com as moléculas de água estruturadas em concha ao redor do aminoácido. Esta característica pode explicar como um único heterodímero pode se ligar a uma matriz de ligantes.
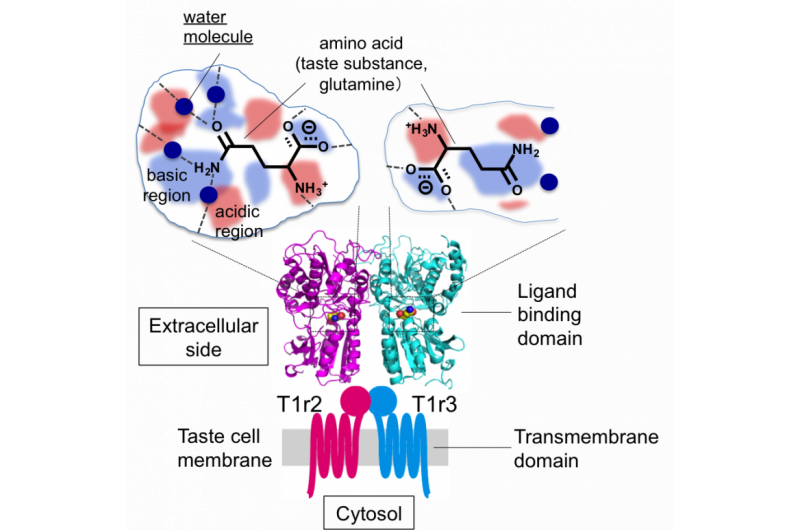
Figura 2:Estrutura geral do receptor de sabor e desenho esquemático das bolsas de ligação da substância de sabor. Crédito:Okayama University
"Descobrimos que o espaço em que o ligante se liga a T1r2 é muito maior do que o próprio ligante. Esse espaço maior poderia ser responsável pela água estruturada, "Yamashita disse." O espaço nos receptores com chave e fechadura é muito menor. "
Uma propriedade semelhante é encontrada em receptores que transmitem diferentes tipos de drogas, sugerindo que este mecanismo pode ser constante para receptores não específicos.
Embora a formação do heterodímero seja necessária para a percepção, os resultados indicaram que T1r2 foi responsável pela detecção de diferentes aminoácidos e que a ligação a T1r3 não teve um papel direto no reconhecimento de sabores.
Por razões de preparação dos receptores, o grupo escolheu estudar o heterodímero do peixe medaka T1r2-T1r3 em vez da versão humana. Ainda, porque a família T1r é universal em animais de níveis superiores, essas descobertas devem servir de modelo informativo para a sensação do paladar em humanos.