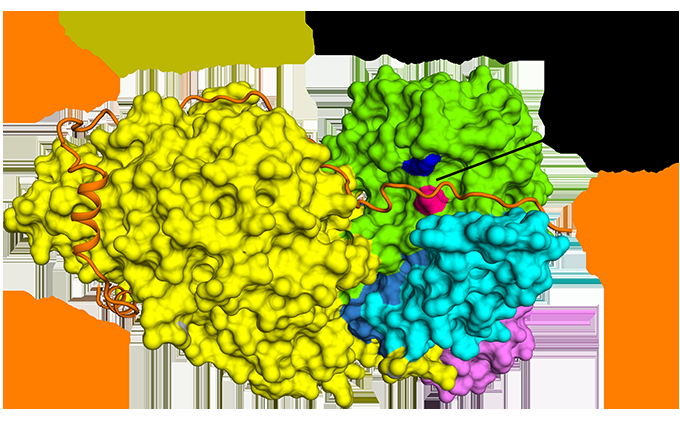
 p Figura 1:A ligação antiparalela da securina em comparação com a separase. Crédito:Diamond Light Source
p Figura 1:A ligação antiparalela da securina em comparação com a separase. Crédito:Diamond Light Source
p A estrutura de um importante complexo de proteínas que regula a transição da metáfase para a anáfase durante a progressão do ciclo celular foi resolvida usando microscopia crioeletrônica (crio-EM) na Diamond Light Source. O estudo estrutural, detalhado em
Nature Structural and Molecular Biology , forneceu informações valiosas sobre o funcionamento interno do complexo separase-securin. p A separase é uma enzima responsável pela clivagem das subunidades kleisin (Scc1 e Rec8) do anel de coesina que mantém as cromátides irmãs juntas durante a mitose. Uma vez que as cromátides são liberadas pela separase, eles segregam em pólos opostos da célula, pronto para formar novos núcleos em duas células-filhas idênticas. A separase é mantida sob controle por um chaperone inibitório conhecido como securin, que também se acredita intrigantemente ter propriedades ativadoras.
p Embora descoberto há quase 20 anos, só recentemente a estrutura da separase ligada à securina foi elucidada. O Cryo-EM foi realizado no Electron Bio-Imaging Center (eBIC) em Diamond para determinar a estrutura do complexo completo e explorar a interação molecular entre separase e securina. Foi descoberto que a securin forma uma conformação estendida para interagir ao longo de todo o comprimento da separase, e inibe a enzima por meio de um mecanismo de pseudo-substrato no sítio ativo. Uma compreensão completa dessa interação e da natureza do controle do ciclo celular pode abrir novos caminhos para o design de drogas direcionadas.
p
Um complexo regulador do ciclo celular
p Quando os cromossomos são replicados, cada um contém duas cromátides irmãs, e durante a divisão celular, essas cromátides devem se separar de maneira coordenada e precisa para produzir dois núcleos filhos idênticos. No início da mitose, as cromátides irmãs são mantidas juntas por um complexo de proteínas chamado coesina; Contudo, durante a transição da metáfase para a anáfase, a coesina é clivada por uma enzima protease conhecida como separase para separar as cromátides e permitir que se movam para lados opostos da célula imediatamente antes de se dividir.
p A transição da metáfase para a anáfase começa quando uma grande ubiquitina ligase E3 multi-subunidade, chamado de complexo promotor de anáfase (ou APC / C) marca uma chaperona inibitória, chamado securin, com ubiquitina para destruição. Uma vez que a securin é degradada, separase é livre para clivar a coesina e separar as cromátides.
p O complexo separase-securina é fundamental para a divisão celular, ainda a estrutura desta dupla não havia sido resolvida em sua totalidade. Dr. Andreas Boland, O pesquisador de pós-doutorado do grupo do Dr. David Barford no Laboratório de Biologia Molecular do MRC e co-pesquisador principal do estudo explicou por que este complexo é tão fascinante:"A má segregação de material genético pode levar à aneuploidia e tumorigênese, portanto, esta é uma das etapas mais importantes durante a progressão do ciclo celular. Paradoxalmente, securin não apenas evita a clivagem prematura de coesina, mas também pode promover a atividade separase. Para entender os mecanismos duais de ativação e repressão em detalhes, usamos crio-EM de partícula única. "
p
Estrutura Cryo-EM com resolução de 3,8 Å
p Complexos de separase-securina de C. elegans e humanos foram expressos, purificado, e aplicado a grades de ouro e carbono cobertas com óxido de grafeno antes de serem rapidamente congeladas em etano líquido. Micrografias Cryo-EM foram coletadas usando o microscópio Titan Krios no eBIC com uma ampliação calibrada de 47, 619, que correspondia a um tamanho de pixel de 1,05 Å.
p O Dr. Boland observou o valor do crio-EM para esta aplicação:"Os complexos de proteínas são relativamente pequenos em tamanho, com menos de 250 kDa para o humano e apenas cerca de 150 kDa para o complexo C. elegans, mas eles contêm vários domínios e são flexíveis, então eles eram materiais desafiadores para cristalizar. Cryo-EM é uma opção viável, mesmo para pequenos complexos de proteínas como este. "
p Pela primeira vez, crio-EM foi usado para determinar a estrutura de resolução quase atômica do complexo separase-securina de C. elegans. Além disso, a estrutura do equivalente humano do complexo foi resolvida para uma resolução média, revelando a conservação evolutiva da forma triangular da separase.
p O Cryo-EM permitiu que a equipe visualizasse como o securin se relaciona com a separase. Ele adota uma conformação antiparalela estendida para se ligar a manchas hidrofóbicas ao longo de todo o comprimento da separase. Curiosamente, essas interações hidrofóbicas também mostraram estabilizar a separase, potencialmente explicando os efeitos ativadores da securina na separase. Além disso, securina interage com o sítio catalítico da separase por meio de um mecanismo de pseudo-substrato. Um resíduo de arginina presente na posição de clivagem P1 nos substratos de coesina Scc1 e Rec8 é substituído na securina por um resíduo hidrofóbico. Esta substituição é responsável por distorcer a geometria do sítio catalítico da separase na posição de clivagem do substrato, conseqüentemente bloqueando sua atividade de protease.
p A separase é crucial para a progressão do ciclo celular, então pode ser um alvo farmacêutico interessante. Mutações, superexpressão, e a localização incorreta da separase mostrou estar associada ao desenvolvimento de tumores, como câncer de mama.
p O Dr. Boland planeja continuar estudando o complexo:"No futuro, queremos melhorar a resolução do complexo separase-securina humana para alcançar uma resolução atômica ou quase atômica. Gostaríamos também de entender como o complexo separase-securina é ligado e ubiquitinado pelo APC / C para marcá-lo para destruição, por isso, continuaremos usando cryo-EM para essa finalidade. "
