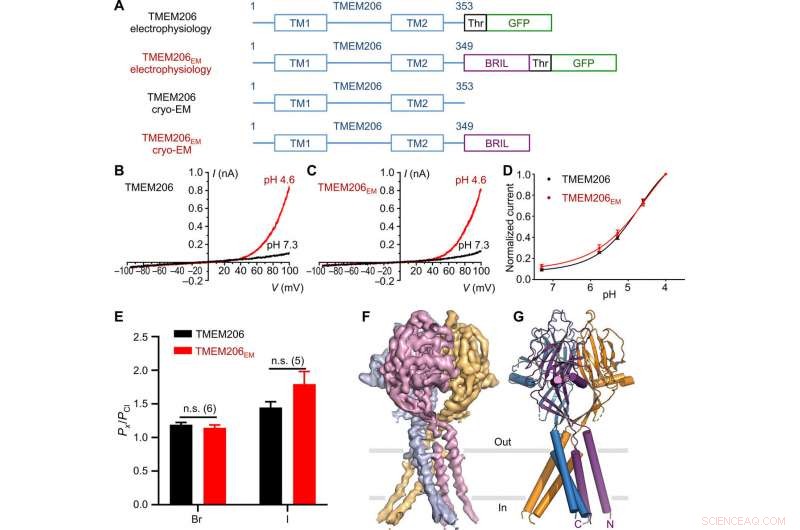
Função e estrutura do baiacu TMEM206. (A) Esquema de construtos de canal usados para eletrofisiologia e experimentos crio-EM de partícula única. “Thr” representa um local de clivagem da trombina. (B e C) Traços de corrente de célula inteira representativos ativados por pH extracelular 4,6 para baiacu TMEM206 (B) e TMEM206EM (C). As construções de canal foram expressas em células 293T de rim embrionário humano (HEK) nocaute TMEM206. (D) Relações de corrente para pH normalizadas do baiacu TMEM206 (n =6 a 9 células por ponto de dados) e TMEM206EM (n =5 a 6 células por ponto de dados). Todas as correntes foram registradas em temperatura ambiente e normalizadas para correntes de pH 4,0 a +100 mV. (E) Seletividade de ânions para baiacu TMEM206 e TMEM206EM. Os dados são apresentados como médias ± SEM (n.s., não significativo; Teste t de Student). (F) Densidade crio-EM do baiacu TMEM206EM contornado em 7,0 σ e colorido por subunidades individuais. (G) Estrutura trimérica do baiacu TMEM206EM. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.abe5983
A proteína transmembrana 206 abreviada como TMEM206 é um canal de cloreto conservado evolutivamente que está subjacente à expressão ubíqua, ativado por próton, retificando externamente as correntes aniônicas. Em um novo relatório agora publicado em Avanços da Ciência , Zengqin Deng e uma equipe de pesquisa multidisciplinar da Escola de Medicina da Universidade de Washington, em Saint Louis, Os EUA descreveram a estrutura da microscopia crioeletrônica (crio-EM) do baiacu TMEM206. A estrutura formou um canal trimérico com dois segmentos transmembrana e um grande domínio extracelular. De acordo com os resultados, Deng et al. mostrou como um amplo vestíbulo na região extracelular pode ser acessado lateralmente a partir de três portais laterais, onde o poro central continha várias construções. Por exemplo, um resíduo de lisina conservado próximo à região citoplasmática da hélice interna, presumivelmente formou o filtro de seletividade de íon cloreto. A estrutura central e a montagem se assemelhavam às dos canais de sódio que não estão relacionados na sequência de aminoácidos, e, portanto, conduzem cátions em vez de ânions. Juntamente com a eletrofisiologia, eles forneceram insights sobre a condução e passagem de íons para uma nova classe de canais de cloreto que são arquitetonicamente distintos das famílias de canais de cloreto descritas anteriormente.
Canais de íons de cloreto
Os íons de cloreto são ânions abundantes em animais, e eles se movem através das membranas celulares através de canais de cloreto e transportadores para uma variedade de funções celulares, incluindo regulação do volume celular, acidificação intracelular e controle da excitabilidade nos músculos. Os íons são amplamente observados em células de mamíferos, embora os componentes moleculares por trás das correntes de cloreto tenham permanecido indefinidos até agora. Dois estudos independentes que usaram a triagem de interferência de RNA de todo o genoma identificaram o TMEM206 como o canal aniônico subjacente. O TMEM206 é conservado evolutivamente em vertebrados. Os canais de cloreto são diversos na sequência de aminoácidos e na arquitetura tridimensional. Nesse trabalho, Deng et al. apresentou uma estrutura de microscopia crioeletrônica (crio-EM) do baiacu TMEM206 para revelar uma arquitetura de canal trimérico diferente das previamente conhecidas. Os cientistas combinaram a eletrofisiologia com este trabalho para fornecer a primeira descrição estrutural e funcional de um canal de cloreto evolutivamente conservado e amplamente expresso para estabelecer uma estrutura molecular e compreender a condução de cloreto e a passagem de canal.
Estrutura da subunidade e montagem do canal. (A) Estrutura de uma única subunidade, mostrando o domínio transmembrana (vermelho), domínio β interno (azul), domínio β externo (laranja), e HTH (verde). Elementos de estrutura secundária são indicados. (B) Montagem de canal trimérico. Duas das subunidades são mostradas na representação de superfície. (C) Vista ortogonal como em (B), do lado extracelular. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.abe5983 
Os pesquisadores usaram construções marcadas com proteína fluorescente verde para identificar candidatos a TMEM206 e baiacu selecionados TMEM206 devido à sua identidade de sequência compartilhada de 50 por cento com o canal de cloreto humano. Deng et al. em seguida, purificou a proteína de tamanho total do baiacu TMEM206 e a submeteu a uma análise crio-EM de partícula única. Usando mapas de reconstrução 3D, eles revelaram uma arquitetura de canal trimérico com domínios transmembrana e extramembrana. O TMEM206 formou um trímero simétrico, onde cada subunidade continha um domínio transmembranar (TMD) com duas hélices que abrangem a membrana denominadas TM1 e TM2 e um grande domínio extracelular (ECD) enriquecido com domínios β com motivos adicionais ainda organizados nas camadas superior e inferior. Adicionalmente, contatos extensos da cadeia lateral foram envolvidos por meio de interações de van der Waals nos domínios β interno e externo. O conjunto de canal trimérico introduziu três aberturas laterais ou portais laterais no meio da região extracelular para provavelmente facilitar a passagem de íons e água. Os portais laterais alongados se estendiam até a junção ECD-TMD para retomar as interações de compactação. Para superar quaisquer dificuldades técnicas de determinar a estrutura da proteína, Deng et al. fundiu o terminal C da proteína transmembrana induzida por interferon restrito ao osso (abreviado BRIL); uma proteína de feixe de quatro hélices amplamente utilizada como acompanhante de cristalização para melhorar a estabilidade da membrana e promover a formação de cristais.
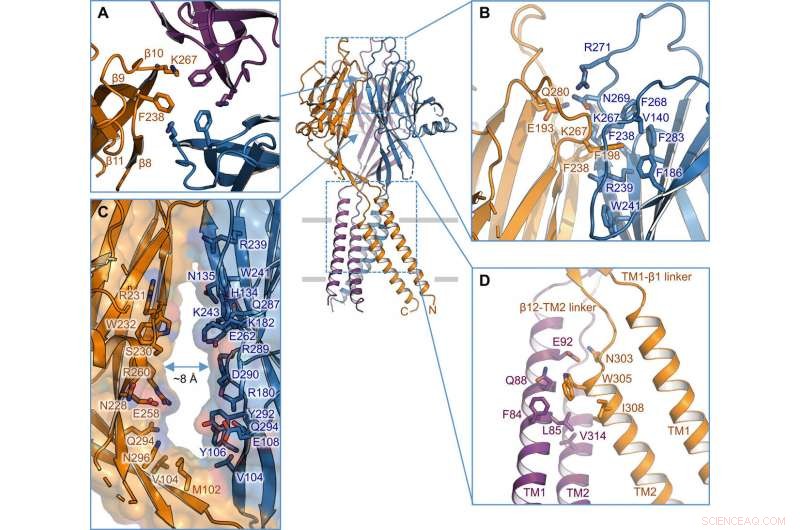
Interface entre subunidades. (A) Interface trimérica no ápice do ECD. As cadeias laterais de K267 e F238 são destacadas. (B) Vista lateral da interface entre as subunidades na camada superior do ECD. Os resíduos envolvidos na interface são mostrados na representação stick. (C) Portal lateral no meio do ECD entre duas subunidades vizinhas. A superfície e os resíduos que revestem a parede são ilustrados. (D) Interface entre subunidades TM1-TM2. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.abe5983
Via de permeação de íons e estudos de mutagênese
Usando cálculos de raio de poro, Deng et al. mostraram como o poro de condução de íons central continha múltiplas constrições para evitar a passagem de íons. A estrutura representou conformação não condutiva devido às condições tampão de alto pH (pH 8,0) usadas para determinar a estrutura crio-EM. O vestíbulo central volumoso e alongado pode ser acessado lateralmente devido à falta de contatos proteína-proteína no domínio extracelular. O ponto estreito do canal da proteína não interfere na condução do íon e pode ser mantido durante o ciclo de passagem do canal, à medida que os íons passam pelos três portais laterais. O potencial eletrostático levemente positivo das paredes internas do vestíbulo central e das entradas laterais também facilitou a atração de íons cloreto. Na junção domínio extracelular-domínio transmembranar (ECD-TMD), três fitas conectadas às hélices externas e movidas para dentro para unir as hélices internas para gerar uma porta extracelular acima da camada bilipídica. Construções consecutivas nas posições voltadas para os poros formaram uma porta hidrofóbica que poderia proibir a condução de íons.
Para apoiar as descobertas estruturais, Deng et al. realizaram estudos de mutagênese nos principais resíduos vivos dos poros. Quando eles substituíram os resíduos básicos conservados por resíduos de alanina ou ácidos, as correntes de cloreto ativadas por ácido foram abolidas. Em contraste, As substituições de arginina retiveram a função de canal para apoiar ainda mais a necessidade de cargas positivas no filtro seletivo de ânion. Por exemplo, o domínio I310 formou um componente crítico da porta transmembrana e outra estrutura conhecida como K320 formou o filtro de seletividade aniônica. O trabalho apoiou a conservação estrutural entre os ortólogos humanos e baiacu para representar um modelo fisiologicamente relevante para canais de cloreto.
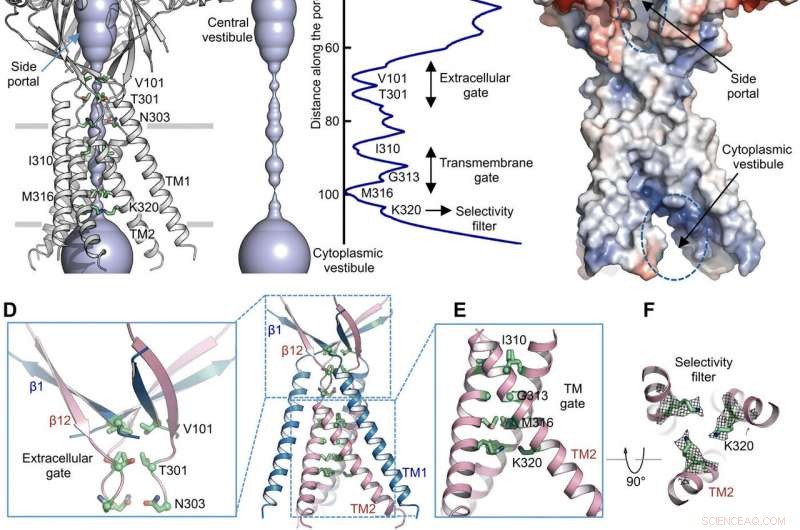
Via de permeação de íons. (A) Estrutura de TMEM206EM e o poro de condução de íons central, mostrado na representação de superfície. Os resíduos que geram constrições são destacados e rotulados. O portal lateral é indicado. (B) Poro de condução iônica central e estimativa do raio (painel direito). (C) Representação da superfície do canal, colorido pelo potencial eletrostático de superfície (vermelho, −5 kT / e; Branco, neutro; azul, +5 kT / e). O portal lateral e o vestíbulo citoplasmático são indicados. (D) Porta extracelular na junção ECD-TMD. V101, T301, e N303 são mostrados em representação em bastão. (E) Portão transmembrana, constituído por I310, G313, e M316. (F) Filtro de seletividade putativa definido por K320. Também são mostradas as densidades da cadeia lateral para K320, contornado em 6,5 σ. (G e H) Densidades de corrente com um pH extracelular de 7,3 (G) e 4,6 (H) a +100 mV para mutantes TMEM206. As correntes de membrana de célula inteira foram registradas usando uma rampa de voltagem de −100 a +100 mV por 500 ms em um potencial de retenção de 0 mV. (I) Razão de densidade de corrente em pH 4,6 a pH 7,3. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.abe5983
Convergência estrutural
A topologia, estrutura e montagem de TMEM206 representado aqueles do canal de sódio epitelial (ENaC) / superfamília degenerina de canais iônicos, incluindo canais iônicos com detecção de ácido (ASICs); apesar da falta de homologia de sequência de aminoácidos distinta entre os dois canais. Os canais triméricos para íons de sódio e cloreto de carga oposta, no entanto, compartilhava uma estrutura central comum flanqueada por duas hélices transmembrana. A equipe observou como o portão extracelular entre o vestíbulo central e o poro transmembrana pode ser expandido para passar íons após a ativação do canal. Embora os canais de sódio epiteliais possam ser ativados pela liberação de peptídeos inibitórios por meio de proteólise no domínio extracelular, os ASICs e TMEM206 só podiam ser ativados por prótons extracelulares. As características estruturais conservadas entre TMEM e AS1CS também sugeriram mudanças conformacionais de passagem análogas para as duas moléculas.
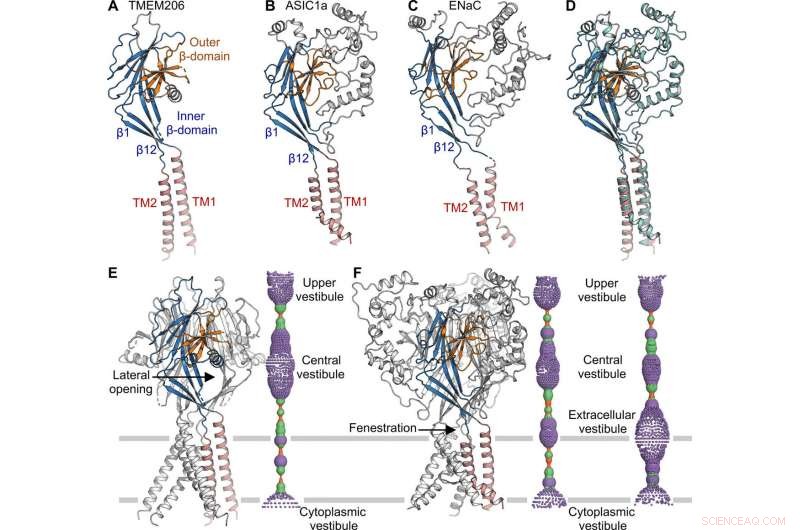
Comparação estrutural com ASIC e ENaC. (A a C) Estruturas de subunidade de TMEM206 (A), ASIC1a [Protein Data Bank (PDB):6AVE] (B), e ENaC (PDB:6BQN) (C). Os domínios têm cores semelhantes. (D) Superposição de TMEM206, colorido como em (A), e ASIC1a colorido em ciano. (E) Canal TMEM206 trimérico e seu poro central de condução de íons. O poro é estimado usando o programa HOLE e representado como pontos coloridos (raio do poro:vermelho <1,15 Å
Panorama
Desta maneira, Zengqin Deng e colegas usaram crio-EM de partícula única para determinar a estrutura das proteínas de membrana integral que são tipicamente inatingíveis usando cristalografia de raios-X tradicional. Ainda é um desafio técnico significativo atingir a resolução quase atômica para proteínas de membrana de tamanho pequeno devido ao baixo contraste e à razão sinal-ruído. Deng et al. obteve uma estrutura de resolução de 3,5 angstrom de um canal pela fusão de uma pequena chaperona de cristalização BRIL para melhorar a estabilidade das proteínas de membrana de outra forma subótimas para promover o empacotamento de cristais. Com base na estrutura central conservada, os canais eram seletivos tanto para cátions quanto para ânions e experimentavam mudanças conformacionais de passagem semelhantes. O trabalho estabeleceu uma nova classe de canais de cloreto para formar uma nova estrutura para futuras investigações funcionais e mecânicas em biologia celular e estrutural.
© 2021 Science X Network