Figura 1. A estrutura em forma de fita do complexo do fotossistema II (PDB ID:3ARC). Crédito:Kobe University
A fotossíntese requer um mecanismo para produzir grandes quantidades de energia química sem perder o poder oxidativo necessário para quebrar a água. Uma equipe de pesquisa japonesa esclareceu parte deste mecanismo, marcando mais um passo para o desenvolvimento potencial da fotossíntese artificial. Os resultados foram publicados em 27 de fevereiro na edição online do Journal of Physical Chemistry Letters .
A equipe foi liderada pelo professor KOBORI Yasuhiro (Centro de Pesquisa em Fotociência Molecular da Universidade de Kobe) e pelo aluno de doutorado HASEGAWA Masashi (Escola de Graduação em Ciências) com o Professor Associado MINO Hiroyuki (Escola de Ciências da Universidade de Nagoya).
Durante a reação de divisão da água na fotossíntese, as plantas produzem oxigênio convertendo a energia solar em energia química, fornecendo a fonte de energia necessária para sua sobrevivência. Essa reação é realizada por um complexo de proteínas nos cloroplastos (localizado nas folhas), denominado complexo do fotossistema II (ver figura 1).
Em 2015, a equipe de pesquisa do professor Kobori conseguiu analisar as interações eletrônicas e a colocação tridimensional da separação de carga inicial produzida diretamente após a fotorreação no centro de reação fotossintética de bactérias roxas, que não causam o potencial de oxidação para divisão da água. Contudo, no complexo do fotossistema II para plantas superiores, a configuração do estado inicial de separação de carga não estava clara, e era um mistério como isso levou a uma reação eficaz de divisão da água, mantendo o alto poder oxidativo.
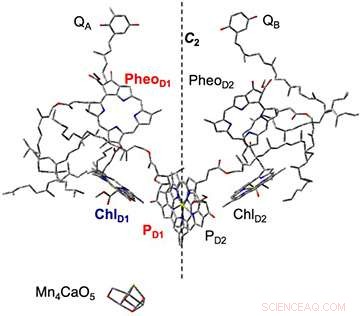
Figura 2. A composição das moléculas de pigmento no centro da reação do complexo do fotossistema II, clarificado por análise estrutural de raios-x. Com base no processo de separação de carga inicial, uma carga negativa ocorre na feofitina (PheoD1) e uma carga positiva na clorofila (PD1). Desta vez, plastoquinona (QA, QB) foi pré-reduzida:as amostras de membrana tilacóide nas quais a transferência de elétrons da feofitina foi suspensa foram irradiadas, e o estado de separação de carga (PheoD1- ・ PD1 + ・) foi capturado. Mn4CaO5 é oxidado de PD1 + ・ e serve como um catalisador para a separação da água. Crédito:Kobe University
Os cientistas extraíram membranas tilacóides (onde a fotorreação ocorre na fotossíntese) do espinafre, adicionado um agente redutor, e irradiou as amostras. Isso permitiu que eles detectassem sinais de micro-ondas do estado inicial de separação de carga com um grau de precisão de 10 milionésimos de segundo (veja a figura 3a). Eles desenvolveram um método para analisar os sinais de microondas usando imagens de polarização de spin. Pela primeira vez foi possível realizar uma análise de visão 3-D da configuração da carga elétrica produzida diretamente após a exposição à luz como um intermediário reativo. Isso foi feito com uma precisão de 10 milionésimos de segundo, como fotografia consecutiva (ver figura 3b). Com base nesta visualização, eles também quantificaram a interação eletrônica que ocorre quando as órbitas de elétrons se sobrepõem para moléculas com cargas elétricas (figura 3c).
A estrutura inicial de separação de carga elétrica esclarecida por esta análise não era muito diferente da estrutura antes da reação, mas a análise de imagem mostrou que a carga elétrica positiva que ocorreu no pigmento como um intermediário reativo existia desproporcionalmente nas moléculas individuais de clorofila (figura 3b, c). Isso sugere que há uma forte estabilização causada pela interação eletrostática entre as cargas.
Foi revelado que o retorno da carga negativa é suprimido, uma vez que a sobreposição entre as órbitas de elétrons é muito limitada pelo efeito isolante do terminal do grupo vinil. Isso significa que se torna possível usar o alto poder oxidante da carga positiva da clorofila (PD1) para a decomposição oxidativa subsequente da água.
Com base nessas descobertas, os pesquisadores desbloquearam parte do mecanismo para produzir efetivamente grandes quantidades de energia química sem perda do poder oxidativo necessário para dividir a água na fotossíntese. Essas descobertas podem ajudar a projetar um "sistema de fotossíntese artificial" que pode fornecer uma fonte de energia limpa, convertendo de forma eficiente a energia solar em grandes quantidades de eletricidade e hidrogênio. A aplicação deste princípio pode contribuir para a resolução de problemas com energia, o meio ambiente e a escassez de alimentos.
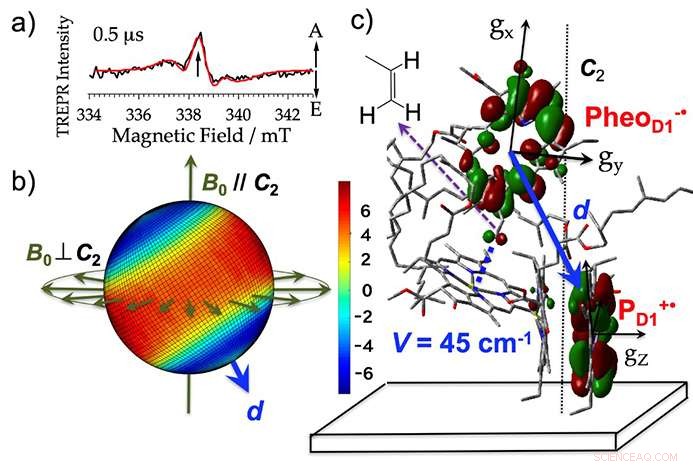
Figura 3. a) O espectro para o complexo do fotossistema II obtido usando ressonância paramagnética eletrônica resolvida no tempo (TREPR). A e E mostram os sinais de microondas para absorção e emissão (polarização do spin do elétron). b) A imagem 3D de (a) a polarização do spin do elétron mapeada para todas as direções possíveis do campo magnético a uma intensidade do campo magnético de ressonância de 338,3 mT. O vermelho e o azul mostram, respectivamente, a intensidade de absorção e emissão do microondas. Para as amostras em que o filme está alinhado com o eixo da membrana tilacóide, as mudanças de sinal obtidas quando a direção do campo magnético externo (B0) em relação à direção normal do plano do filme (C2) são paralelas (B0 // C2) e perpendiculares (B0⊥C2) suportam esta imagem tridimensional. d mostra o vetor direcional que liga as cargas elétricas. c) A localização da órbita do estado inicial de separação de carga elétrica (PheoD1- ・ PD1 + ・) no centro de reação. Crédito:Kobe University