O método CRISPR aprimorado permite a inserção estável de genes grandes no DNA de plantas superiores
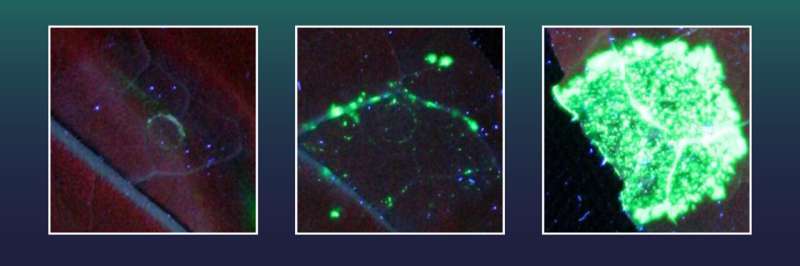 Cada ponto fluorescente verde representa uma célula foliar na qual um grande segmento genético foi inserido com sucesso no genoma da planta. Diferentes variantes de Cas9 foram usadas:um Cas9 inativo (esquerda), um Cas9 ativo (centro) e Cas9 fundido com uma exonuclease (direita) Crédito:Tom Schreiber, IPB, Instituto Leibniz de Bioquímica Vegetal, IPB
Cada ponto fluorescente verde representa uma célula foliar na qual um grande segmento genético foi inserido com sucesso no genoma da planta. Diferentes variantes de Cas9 foram usadas:um Cas9 inativo (esquerda), um Cas9 ativo (centro) e Cas9 fundido com uma exonuclease (direita) Crédito:Tom Schreiber, IPB, Instituto Leibniz de Bioquímica Vegetal, IPB Cientistas do Instituto Leibniz de Bioquímica Vegetal (IPB) conseguiram, pela primeira vez, inserir de forma estável e precisa grandes segmentos genéticos no DNA de plantas superiores de forma muito eficiente. Para fazer isso, eles otimizaram o método de edição genética CRISPR/Cas, comumente conhecido como “tesoura genética”.
O método CRISPR melhorado oferece grandes oportunidades para a modificação direcionada de genes em plantas superiores, tanto para melhoramento como para investigação. O estudo, liderado pelo Prof. Alain Tissier e Dr. Tom Schreiber, foi publicado na Molecular Plant .
CRISPR/Cas é um método com enorme potencial para a modificação direcionada de genes individuais. No entanto, isto não se aplica a todos os tipos de modificações genéticas que criadores e cientistas têm nas suas listas de desejos. Embora as tesouras genéticas sejam ideais para eliminar genes, ou seja, desligar ou remover genes existentes, elas não funcionam bem para inserir genes com precisão ou substituir segmentos genéticos. Até à data, as tesouras genéticas têm sido demasiado ineficientes e, portanto, de pouca utilidade para a inserção direccionada de genes no ADN de plantas superiores.
“A razão para isso é o maquinário interno de reparo de quebras de DNA da planta”, diz Schreiber. Estas enzimas de reparação estão imediatamente presentes assim que ocorre dano ao DNA. Eles também reconhecem os cortes suaves feitos pela tesoura genética e unem instantaneamente as duas cadeias de DNA cortadas da dupla hélice. Essa colagem do DNA cortado ocorre muito rapidamente e não com muita precisão; há pequenas perdas de informação nas quais pequenas seções de DNA são perdidas ou adicionadas.
“Essas imprecisões não são um problema em projetos knock-out e são até desejáveis”, diz Schreiber, “porque quero desligar o gene de qualquer maneira. Mas se eu quiser inserir um gene, isso terá que ser feito com muita precisão. a informação genética deve ser inserida com exatidão, não pode faltar um único componente e nem um único componente adicional pode ser integrado, caso contrário o gene perde a sua função e toda a experiência foi em vão."
Por esta razão, a inserção precisa e sem cicatrizes mediada por CRISPR/Cas de genes maiores ou segmentos de DNA só teve sucesso em raros casos individuais até o momento. Para aumentar a taxa de sucesso da inserção de genes, os cientistas de Halle equiparam a tesoura genética com uma enzima adicional, a chamada exonuclease.
As exonucleases podem alterar os locais de clivagem do ADN criados pelas tesouras genéticas de tal forma que as enzimas de reparação internas da célula já não conseguem reconhecer e reparar os danos no ADN. O segmento de DNA a ser inserido pelo CRISPR/Cas teria, portanto, tempo suficiente para se integrar na posição correta através de outro mecanismo de reparo celular muito preciso.
No experimento, os cientistas de Halle testaram várias exonucleases de origem viral, bacteriana, vegetal e humana quanto à sua capacidade de aumentar o número de eventos precisos de inserção de genes. Eles introduziram a tesoura genética com as exonucleases correspondentes e um segmento do gene X nas células das folhas da planta do tabaco Nicotiana benthamiana.
Estas células de tabaco já haviam sido equipadas com um gene para um marcador fluorescente verde. Eles também continham um gene X destruído, necessário para a formação do corante verde fluorescente. No entanto, o marcador fluorescente não pode ser gerado enquanto faltar grande parte da informação genética do gene X.
O marcador verde só pode ser produzido quando a seção faltante do gene X é reinserida com precisão usando CRISPR/Cas, reparando assim o gene X. Cada célula com inserção genética bem-sucedida ficará fluorescente em verde e os pesquisadores podem simplesmente contar a taxa de eventos de inserção genética bem-sucedida. .
Duas das exonucleases testadas, incluindo uma da família do vírus do herpes, revelaram-se particularmente eficazes. Usando estes, a equipe de Halle alcançou 38 vezes mais eventos de inserção genética perfeita do que apenas com CRISPR/Cas.
Esta abordagem experimental foi então testada com outros genes a incorporar e noutras plantas, nomeadamente o agrião (Arabidopsis thaliana) e o trigo. Como a inserção do gene nas plantas de tabaco ocorreu apenas localmente nas folhas, o gene integrado foi perdido na próxima geração filha e, portanto, só esteve presente no genoma por um tempo limitado.
É por isso que na Arabidopsis e no trigo, os especialistas do Halle CRISPR tentaram incorporar o gene nas células germinativas para garantir uma herança estável às futuras gerações de plantas. Com a ajuda das exonucleases testadas, o knock-in de genes estáveis, isto é, hereditários, revelou-se bem-sucedido em Arabidopsis com um aumento de dez vezes na frequência e no trigo em mais de 1% das plantas filhas.
“Um por cento não parece muito a princípio”, explica Schreiber, “mas se um criador quiser introduzir uma determinada característica em sua planta, ele só terá que examinar cerca de 50 a 100 plantas filhas de primeira geração usando nosso CRISPR otimizado. /Cas para encontrar uma planta com a característica desejada Isto pouparia uma quantidade considerável de tempo em comparação com os métodos de melhoramento convencionais, onde 500 a 1.000 plantas teriam que ser analisadas para este fim."
Portanto, o método CRISPR/Cas otimizado é uma ferramenta promissora para a inserção direcionada de genes em plantas superiores e possivelmente também em outros organismos. No futuro, os criadores de plantas poderão utilizar este método, por exemplo, para reintroduzir genes de resistência perdidos contra agentes patogénicos de espécies selvagens ou variedades cultivadas antigas em variedades de elite modernas e de alto rendimento. Dessa forma, características desejáveis como estas poderiam melhorar o melhoramento de plantas e contribuir para o desenvolvimento de variedades de culturas mais robustas.
Para a ciência, esta abordagem oferece grandes oportunidades para substituir elegantemente certos genes de plantas por cópias modificadas deles mesmos, num único passo. Isto é particularmente útil para elucidar a função genética.
