Cientistas elucidam reconhecimento de substrato e mecanismo de acoplamento de prótons da proteína transportadora VMAT2
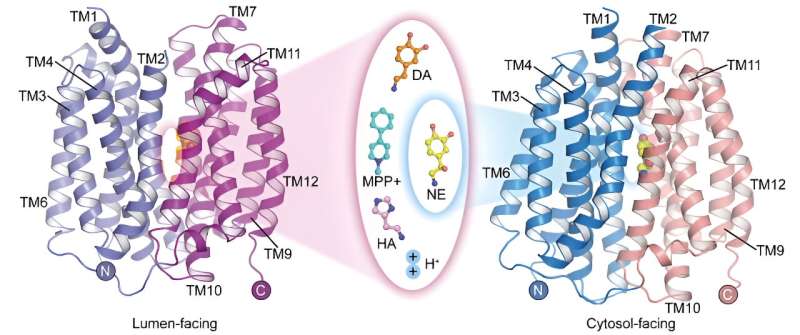 A estrutura dos neurotransmissores e neurotoxinas de ligação ao VMAT2. Crédito:grupo de Zhao Yan
A estrutura dos neurotransmissores e neurotoxinas de ligação ao VMAT2. Crédito:grupo de Zhao Yan O transportador vesicular de monoaminas 2 (VMAT2) é a única proteína transportadora no sistema nervoso central que medeia o armazenamento de neurotransmissores monoaminas. Desempenha um papel crítico na mediação da transmissão do impulso nervoso e da neuroproteção.
Atualmente, os mecanismos pelos quais o VMAT2 reconhece e transporta vários neurotransmissores monoamina estruturalmente diferentes e o indutor da doença de Parkinson MPP
+
não são claros, e o mecanismo molecular do transporte de substrato acoplado a prótons também precisa ser mais explorado.
Em um estudo publicado na Cell Research em 22 de maio, uma equipe de pesquisa liderada pelo Prof. Zhao Yan do Instituto de Biofísica da Academia Chinesa de Ciências (CAS), em colaboração com o Prof. Jiang Daohua do Instituto de Física do CAS, relatou a estrutura apo do ser humano transportador vesicular de monoamina 2 (hVMAT2) em pH baixo, as estruturas complexas de vesículas voltadas para dopamina, noradrenalina, histamina e a neurotoxina MPP
+
ligação e a estrutura complexa de ligação da norepinefrina no estado voltado para o citosol.
Estas estruturas revelam a base estrutural do reconhecimento do substrato VMAT2 e refinam ainda mais o mecanismo molecular do transporte de substrato acoplado a prótons.
Embora noradrenalina, dopamina, serotonina e MPP
+
têm estruturas moleculares diferentes, as estruturas complexas de ligação do VMAT2 a estes substratos mostram que todos eles se ligam a posições semelhantes na proteína transportadora. No entanto, diferenças sutis em certos grupos funcionais destes substratos levam a diferenças significativas e críticas nas suas interações e modos de ligação com a proteína transportadora. Estas diferenças ilustram como o VMAT2 reconhece eficientemente diferentes moléculas de substrato.
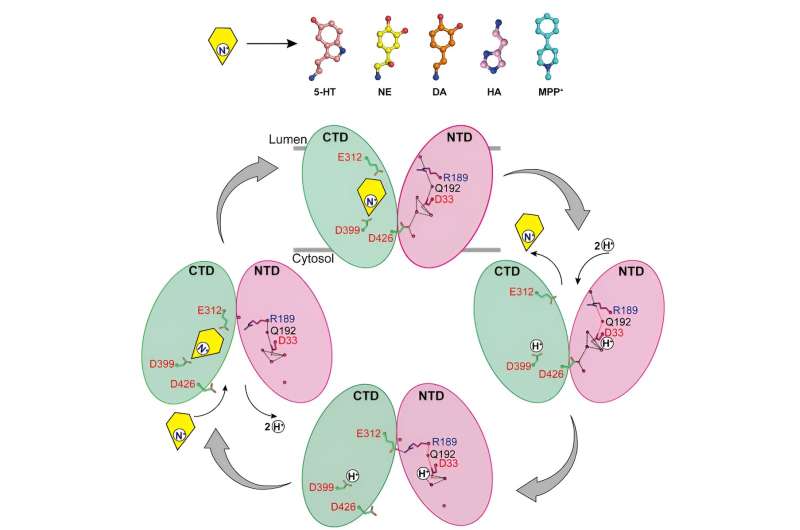 Modelo de mecanismo de transporte de monoaminas VMAT2. Crédito:grupo de Zhao Yan
Modelo de mecanismo de transporte de monoaminas VMAT2. Crédito:grupo de Zhao Yan
Os pesquisadores relataram as estruturas de ligação da norepinefrina ao VMAT2 em diferentes conformações, incluindo as conformações voltadas para o citosol e voltadas para as vesículas.
Apesar das mudanças conformacionais significativas no VMAT2, a bolsa de ligação ao substrato para a norepinefrina permanece relativamente estável durante este processo, sem alterações significativas nas interações com os resíduos circundantes. Esta transição conformacional inteligente é crucial para o funcionamento do VMAT2.
Ao analisar as estruturas do VMAT2 em diferentes condições de pH, foi confirmado que o D33 pode ser outro local chave de protonação.
Ao analisar minuciosamente os mecanismos pelos quais o VMAT2 reconhece diferentes neurotransmissores e neurotoxinas monoamina estruturalmente diversos, este trabalho propõe um modelo molecular para alterações conformacionais do VMAT2 e refina ainda mais o mecanismo específico de transporte de substrato acoplado a prótons.
Essas descobertas fornecem informações valiosas para uma compreensão abrangente do modo de transporte VMAT2, enriquecem o sistema de conhecimento do principal facilitador do transporte de substrato da superfamília e estabelecem uma base importante para o desenvolvimento e otimização de medicamentos.

