Impressão artística de uma unidade organizacional de DNA desmontada, um domínio de associação topológica (TAD). Na análise dos dados, esses domínios aparecem como triângulos que podem ser reestruturados em diferentes tecidos. Crédito:Alessa Ringel/MPIMG
Camadas de controle de genes permitem que o DNA adicione novas informações de forma flexível. Os genes e seus interruptores genéticos são organizados em unidades funcionais para ativar ou desativar os genes conforme necessário. A interrupção dessas unidades pode levar a doenças, mas um novo estudo deixa claro que elas são mais robustas e flexíveis do que se pensava anteriormente. Uma equipe internacional de pesquisadores descobriu que um gene ainda pode funcionar mesmo quando novos segmentos de DNA são inseridos na mesma unidade organizacional genômica.
Dois metros de DNA são colocados no minúsculo núcleo de cada célula humana. Para fornecer à célula a informação certa no momento certo, a molécula de DNA é empacotada e agrupada eficientemente em unidades funcionais. Os genes geralmente se reúnem com suas sequências de controle para construir espaços de trabalho fisicamente separados. Mas o que acontece quando essas unidades são perturbadas durante a evolução – ou no genoma de um paciente individual?
"Alguns dos rearranjos genômicos que vemos na clínica causam doenças, enquanto outros não", diz Stefan Mundlos, da Charité - Universitätsmedizin Berlin e chefe do grupo de pesquisa Desenvolvimento e Doenças do Instituto Max Planck de Genética Molecular (MPIMG). "Ainda não entendemos completamente por que esse é o caso."
De fato, muitas partes do genoma contêm conflitos regulatórios. Um novo estudo publicado na revista
Cell dá as primeiras dicas de como eles são resolvidos. A equipe de pesquisadores de Mundlos estudou um exemplo em que um novo gene foi integrado com sucesso ao genoma sem perturbar os mecanismos de controle preexistentes de genes vizinhos. A equipe esperava que isso também pudesse ser usado para tirar conclusões sobre circunstâncias semelhantes nas células dos pacientes.
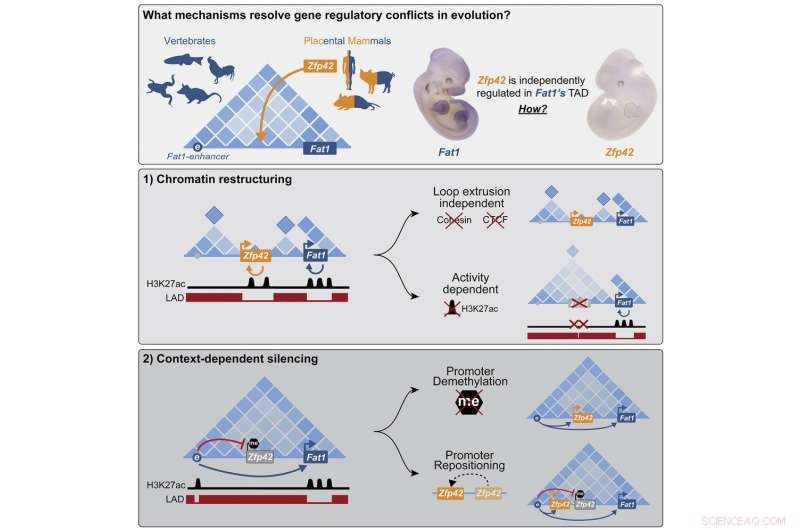
Os pesquisadores exploraram uma mutação que aconteceu no ancestral de todos os mamíferos placentários, um grupo que inclui humanos, mas não marsupiais como o gambá. A mutação inseriu o novo gene Zfp42 diretamente no espaço de trabalho do importante gene de desenvolvimento Fat1, um gene que está envolvido no crescimento e migração de células.
"Descobrimos que as células lidam com o hóspede indesejado com dois mecanismos separados, dependendo da situação em que os genes são necessários", diz Michael Robson, que liderou o projeto. "Em certos tecidos, o novo gene é silenciado epigeneticamente e completamente desligado. Durante o desenvolvimento inicial do embrião, no entanto, ambos os genes estão ativos e a célula reconstrói essa parte do genoma em novas unidades funcionais que permitem o controle individual."
Um recém-chegado ao workshop Robson, seu Ph.D. A estudante Alessa Ringel e seus colegas investigaram o espaço de trabalho organizacional da Fat1. Como muitos outros genes, ele é instruído a ativar em momentos e lugares específicos por outras sequências de DNA chamadas intensificadoras. Para permitir que os potenciadores e os genes se comuniquem, o DNA então se dobra e dobra para reuni-los em um espaço de trabalho protegido. Essas unidades funcionais de DNA são chamadas de domínios topologicamente associados (TADs).
Em galinhas ou gambás, apenas o gene Fat1 está localizado no mesmo TAD que seus potenciadores. Quando o pesquisador empregou a técnica "Hi-C" para ver quais partes do DNA se tocam com mais frequência, o gene e seu intensificador se comportaram conforme o esperado. Nesses animais, o DNA parecia se enrolar em uma única bola, permitindo que ambas as sequências genéticas se misturassem, ativando a Fat1.
"Mas em mamíferos placentários como camundongos ou humanos é um pouco mais complicado", explica Ringel, que é o primeiro autor da publicação. Bem entre o gene Fat1 e seu potenciador, existe este novo gene chamado Zfp42. O mesmo potenciador deve controlar ambos os genes, mas este não é o caso. "Ambos os genes parecem se dar bem - eles têm um comportamento completamente independente, tornando-se ativos em diferentes tecidos em diferentes momentos de desenvolvimento".
Resumo gráfico. Crédito:Célula (2022). DOI:10.1016/j.cell.2022.09.006
Vá dormir ou reconstrua seu espaço de trabalho Para chegar ao fundo da questão de como os genes conseguem evitar uns aos outros, os pesquisadores compararam células de diferentes tecidos de camundongos:o membro embrionário em desenvolvimento e as células-tronco embrionárias.
A partir desses estudos, os pesquisadores descobriram que, em membros embrionários, o intensificador de fato entra em contato com ambos os genes, mas o Zfp42 permanece inativo. Acontece que o recém-chegado ainda está no mesmo espaço de trabalho, mas está dormindo tranquilamente em um canto. O gene havia sido silenciado pela metilação do DNA, uma modificação química que bloqueia os genes em um estado desligado. Mas para colocar o gene Zfp42 para dormir, ele precisa estar exatamente no lugar certo. Assim que os pesquisadores o recortaram e colaram experimentalmente um pouco de cada lado, ele foi ativado pelo intensificador de Fat1.
Os cientistas ficaram surpresos ao descobrir que nas células das células-tronco embrionárias de camundongos, o DNA em torno dos dois genes está organizado de forma completamente diferente. O Zfp42 e o Fat1 agora constroem seus próprios espaços de trabalho fisicamente separados com seus respectivos aprimoradores.
O TAD original se divide em pequenas bolhas de DNA para separar os dois genes. Isso ficou evidente não apenas em experimentos Hi-C que mapearam os pontos de contato entre segmentos de DNA, mas também em imagens microscópicas de alta resolução e modelos de computador que mostraram que cada gene estabeleceu seu próprio pequeno espaço de trabalho.
Um sistema robusto e flexível de controle genético Esses dois novos mecanismos revelam como um único "espaço de trabalho" de DNA pode ser prontamente modificado para hospedar atividades gênicas totalmente diferentes. "É fascinante estudar como diferentes camadas de controle genético se complementam", diz Ringel. "Ficamos surpresos com a flexibilidade de nossos genomas para adaptar e controlar genes em diferentes situações. Por exemplo, nossos resultados mostram que os TADs podem ter estruturas de DNA dinâmicas em vez de estáticas".
O TAD do gene Fat1 foi mantido de forma estável por centenas de milhões de anos de evolução de peixes e sapos a marsupiais, acrescenta o líder do projeto Robson. "A princípio, os espaços de trabalho do TAD parecem frágeis, pois muitas coisas podem dar errado se forem perturbadas", diz ele. “Mas novos genes precisam ir a algum lugar e mostramos como a evolução pode efetivamente modificar domínios regulatórios para adicionar novos genes e funções com segurança”.
"Curiosamente, esse cenário evolutivo reflete o que muitas vezes vemos em pacientes com alterações genômicas extremas, como cromotripsis", diz Mundlos. "Esses pacientes podem ter cromossomos quebrados, mas ainda apresentam apenas sintomas relativamente leves. Isso pode ser explicado por meio desses mecanismos reguladores adicionais que compensam os efeitos nocivos usando as ferramentas que o genoma tem à sua disposição".
+ Explorar mais Explorando os limites moleculares no DNA

