Crédito:Oak Ridge National Laboratory
Embora todos os vírus tenham algum meio de combater o sistema imunológico do corpo, os cientistas têm estudado como o coronavírus SARS-CoV-2 - a causa da pandemia global COVID-19 - pode escapar do sistema imunológico em humanos.
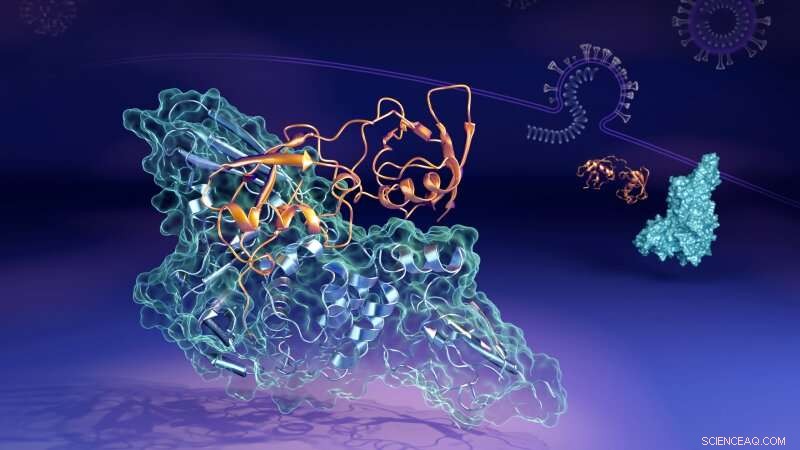
Agora, os cientistas que trabalham no Laboratório Nacional de Oak Ridge (ORNL) do Departamento de Energia dos Estados Unidos (DOE) revelaram os detalhes moleculares de como uma proteína-chave (a protease semelhante à papaína, ou "PLpro") dos links de vírus para formar uma estrutura emparelhada, ou "complexo, "com uma proteína humana chamada gene 15 estimulado por interferon (ISG15). PLpro retira ISG15 de outras proteínas celulares humanas para ajudar a SARS-CoV-2 a evadir a resposta imune. Entender como as duas proteínas interagem pode ajudar no desenvolvimento de tratamentos terapêuticos com drogas que prevenir sua formação e permitir que o sistema imunológico de uma pessoa combata melhor o vírus invasor.
Os resultados da pesquisa, intitulado "Conformational Dynamics in the Interaction of SARS-CoV-2 Papain Like Protease with Human Interferon-Stimulated Gene 15 Protein, "foram publicados no Journal of Physical Chemistry Letters .
“Em células humanas que o vírus infectou, o PLpro do vírus SARS-CoV-2 tende a procurar e se ligar à proteína ISG15, um componente chave da resposta imunológica das células, "disse Hugh O'Neill, líder do grupo de Bio-Instalações do ORNL e diretor do Centro de Biologia Molecular Estrutural do laboratório. "Quando o PLpro se liga ao ISG15, faz com que o ISG15 mude de forma. A principal descoberta é que o ISG15 pode assumir várias formas quando se liga ao PLpro. "
Usando espalhamento de nêutrons de pequeno ângulo (SANS) no Reator de Isótopo de Alto Fluxo (HFIR) de ORNL, os pesquisadores puderam estudar as mudanças no complexo enquanto elas ocorriam.
"Aumentamos o contraste entre o PLpro e o ISG15 ao preparar o PLpro, no qual muitos dos átomos de hidrogênio foram substituídos por átomos de deutério, "disse Kevin Weiss, um especialista em bio-deuteração. "Os nêutrons interagem de maneira diferente com os átomos de deutério, então isso nos ajudou a diferenciar melhor entre as duas proteínas.
"Usamos nêutrons para analisar o complexo em solução, que simula melhor o ambiente fisiológico real do corpo humano, "disse Leighton Coates, gerente de ciência e tecnologia de sistemas de instrumentos para a segunda estação alvo de ORNL. "Isso nos permitiu estudar as formas mutáveis do complexo, que outras técnicas não poderiam ter aprendido. "
"As informações que obtivemos em nossos experimentos aumentam nosso conhecimento de como o vírus funciona e nos permitirá construir modelos de computador mais precisos para outros cientistas usarem, "disse Wellington Leite, autor principal e pesquisador de pós-doutorado do ORNL. "Os pesquisadores poderão usar o modelo para pesquisar rapidamente sites no ISG15 onde o PLpro se conecta e, em seguida, tentar bloquear esses sites."
Susan Tsutakawa, um cientista bioquímico da equipe do Lawrence Berkeley National Laboratory (Berkeley Lab), obteve dados de espalhamento de raios-X de pequeno ângulo (SAXS) no complexo PLpro-ISG15 no Síncrotron de Fonte de Luz Avançada do Laboratório de Berkeley. "Nos estudos SAXS, poderíamos separar diferentes complexos na amostra acoplando SAXS com cromatografia de exclusão de tamanho e, ao mesmo tempo, obter dados de maior resolução da configuração geral do complexo, para complementar os estudos SANS que revelaram as conformações de componentes individuais no complexo, "disse Tsutakawa.
A equipe planeja realizar experimentos adicionais neste tipo de complexo biológico para examinar como pequenas moléculas podem bloquear a ligação de PLpro ao ISG15.