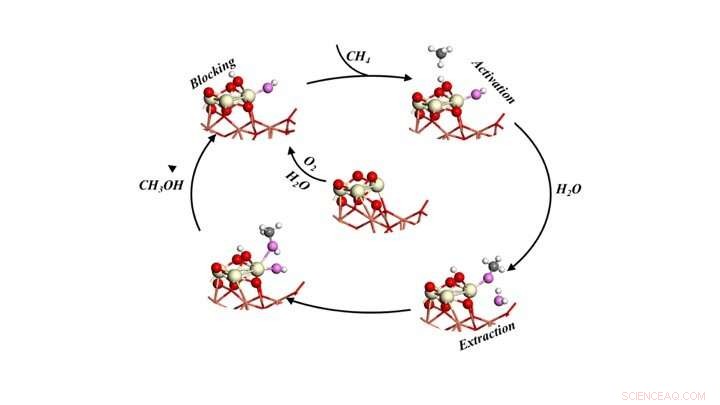
Ciclo catalítico para a conversão seletiva de metano em metanol, expondo o metano ao oxigênio e à água. Crédito:Laboratório Nacional de Brookhaven
Cientistas do Laboratório Nacional de Brookhaven do Departamento de Energia dos EUA e colaboradores revelaram novos detalhes que explicam como um catalisador altamente seletivo converte metano, o principal componente do gás natural, ao metanol, um combustível líquido fácil de transportar e matéria-prima para fazer plásticos, tintas, e outros produtos básicos. As descobertas podem auxiliar no projeto de catalisadores ainda mais eficientes / seletivos para tornar a conversão do metano uma alternativa economicamente viável e ambientalmente atraente para a ventilação ou queima de gás "residual".
Conforme descrito em um artigo publicado em Ciência , a equipe usou modelos baseados em teoria e simulações para identificar os rearranjos em nível atômico que ocorrem durante a reação, e, em seguida, conduziu experimentos para verificar esses detalhes. Os estudos revelaram três papéis essenciais para a água, trabalhando em conjunto com um catalisador de óxido de cério / óxido de cobre econômico, para trazer a conversão de metano em metanol com seletividade de 70 por cento, enquanto bloqueia reações colaterais indesejadas.
"Sabíamos por um trabalho anterior que havíamos desenvolvido um catalisador altamente seletivo para a conversão direta de metano em metanol na presença de água, "disse o químico Sanjaya Senanayake do Brookhaven Lab, quem liderou o projeto. "Mas agora, usando técnicas teóricas e experimentais avançadas, aprendemos por que funciona tão bem. "
As descobertas podem acelerar o desenvolvimento de catalisadores que fazem uso do metano que escapa de poços de gás e petróleo, onde normalmente é ventilado diretamente para a atmosfera ou queimado.
“O transporte de gás é extremamente difícil e potencialmente perigoso, "Senanayake disse." Mas se você convertê-lo diretamente em um líquido, você pode movê-lo e usá-lo em vez de queimar o desperdício. Embora o potencial de comercialização para tal reação ainda possa levar vários anos, Esperamos que nossos resultados e a compreensão de como tudo funciona ajudem a chegar lá mais rápido. "
A teoria estabelece as bases
A busca por catalisadores metano-metanol revelou algumas perspectivas promissoras. Mas muitos operam em várias etapas distintas com altos requisitos de energia. E em muitos casos, as reações concorrentes quebram o metano (e qualquer metanol produzido) completamente em monóxido de carbono (CO) e CO2. Então, quando a equipe de Brookhaven observou pela primeira vez que seu catalisador poderia converter diretamente metano em metanol com alto rendimento em uma reação contínua, eles queriam saber mais sobre como ele executou essa difícil tarefa.
Eles estavam particularmente interessados em descobrir o papel da água, que parecia facilitar as etapas principais do processo e, de alguma forma, bloquear as vias de reação que produziam CO e CO2.
Usando ferramentas computacionais no Brookhaven Lab's Center for Functional Nanomaterials (CFN), Centro de Dados e Computação Científicos de Brookhaven, Stony Brook University (SBU), e o National Energy Research Scientific Computing Center (NERSC) no Lawrence Berkeley National Laboratory do DOE (Berkeley Lab), O químico de Brookhaven, Ping Liu, desenvolveu a abordagem teórica para descobrir o que estava acontecendo.
Primeiro, ela usou cálculos da "teoria funcional da densidade" (DFT) para identificar como os reagentes (metano, oxigênio, e água) mudaram à medida que interagiam entre si e com o catalisador óxido de cério / óxido de cobre em vários estágios durante a reação. Esses cálculos também incluíam informações sobre quanta energia seria necessária para ir de um arranjo atômico para o próximo.
"O DFT dá a você um monte de 'instantâneos' dos estágios envolvidos na reação e os 'solavancos' ou barreiras que você precisa superar para passar de um estágio para o próximo, " ela explicou.
Em seguida, ela realizou simulações de "Monte Carlo cinético" - essencialmente usando computadores para testar todas as maneiras possíveis de a reação ir de um instantâneo para outro. As simulações levam em consideração todos os caminhos possíveis e as necessidades de energia para passar de um estágio a outro.
"Essas simulações começam com cada estágio intermediário e olham para todas as possibilidades que podem ir para a próxima etapa - e descobrir qual é o caminho mais provável, "Liu disse." As simulações determinam a maneira mais provável de conectar os instantâneos em tempo real.
As simulações também modelam como diferentes condições de reação - por exemplo, mudanças na pressão e na temperatura - afetarão as taxas de reação e os caminhos prováveis.
"Havia 45-50 componentes possíveis na 'rede de reação' que estávamos simulando, "disse Jose Rodriguez, um líder do grupo de catálise de Brookhaven que também tem uma nomeação conjunta na SBU. "Destes, Ping, Erwei Huang, e Wenjie Liao, dois Ph.D. alunos da SBU, foram capazes de prever quais seriam as condições mais favoráveis, o melhor caminho, para ir de metano para metanol e não para CO e CO2 - e tudo induzido pela presença de água. "
Os modelos previram três funções para a água:1) ativar o metano (CH4) ao quebrar uma ligação carbono-hidrogênio e fornecer um grupo -OH para converter o fragmento CH3 em metanol, 2) bloquear locais reativos que poderiam potencialmente converter metano e metanol em CO e CO2, e 3) facilita o deslocamento do metanol formado na superfície para a fase gasosa como um produto.
"Toda a ação ocorre em um ou dois sítios ativos na interface entre as nanopartículas de óxido de cério e o filme de óxido de cobre que constituem o nosso catalisador, "Senanayake disse.
Mas essa descrição ainda era apenas um modelo. Os cientistas precisavam de evidências.

Brookhaven Lab e Stony Brook University (SBU) membros da equipe de pesquisa. Primeira linha, da esquerda para a direita:Sanjaya Senanayake (Brookhaven), Mausumi Mahapatra (Brookhaven), Jose A Rodriguez (Brookhaven), Ping Liu (Brookhaven) e Wenjie Liao (SBU). Segunda linha:Ivan Orozco (SBU), Ning Rui (Brookhaven), Zongyuan Liu (Brookhaven) e Erwei Huang (SBU). Crédito:Laboratório Nacional de Brookhaven
Experimentos fornecem prova
Para reunir evidências, os cientistas de Brookhaven e SBU conduziram experimentos adicionais nos laboratórios da Divisão de Química de Brookhaven e fizeram várias viagens para a Fonte de Luz Avançada (ALS) no Laboratório de Berkeley. Esta equipe incluiu SBU Ph.D. o estudante Ivan Orozco e os bolsistas de pós-doutorado Zongyuan Liu, Robert M. Palomino, Ning Rui, e Mausumi Mahapatra.
No ALS, o grupo trabalhou com Slavomir Nemsak do Berkeley Lab e colaboradores Thomas Duchon (Peter-Grünberg-Institut na Alemanha) e David Grinter (Diamond Light Source no Reino Unido) para realizar experimentos usando espectroscopia de fotoelétrons de raios-X (XPS) de pressão ambiente (AP) , o que lhes permitiu rastrear a reação conforme acontecia em tempo real para identificar as principais etapas e intermediários.
"Os raios X excitam elétrons, e a energia dos elétrons diz quais espécies químicas existem na superfície e o estado químico das espécies. Faz uma 'impressão digital química' ", disse Rodriguez." Usando esta técnica, você pode acompanhar a química da superfície e o mecanismo de reação em tempo real. "
Executar a reação com e sem água sob uma variedade de condições confirmou que a água desempenhou os três papéis previstos. As medições mostraram como as condições de reação impulsionaram o processo e maximizaram a produção de metanol, evitando reações colaterais.
"Encontramos evidências diretas da formação de CH3O - um precursor intermediário do metanol - na presença de água, "Rodriguez disse." E porque você tem a água, você modifica toda a química da superfície para bloquear as reações colaterais, e também liberam facilmente o metanol da superfície do catalisador para que não se decomponha. "
"Agora que identificamos os princípios de design do catalisador, "Senanayake disse, "em seguida, temos que construir um sistema real para usar esse catalisador e testá-lo - e ver se podemos torná-lo melhor."