
O experimento foi realizado no instrumento Coherent X-ray Imaging (CXI), que faz uso do rápido, pulsos de raios-X brilhantes da fonte de luz coerente Linac. A CXI aplica o método de “difração antes da destruição” para fazer medições com pulsos de raios X ultracurtos antes que danifiquem seus alvos. Crédito:SLAC National Accelerator Laboratory
Tuberculose, uma doença pulmonar que se espalha no ar por meio de tosses ou espirros, agora mata mais pessoas em todo o mundo do que qualquer outro agente infeccioso, de acordo com o último relatório global sobre tuberculose da Organização Mundial da Saúde. E em centenas de milhares de casos a cada ano, o tratamento falha porque as bactérias que causam a Tb tornaram-se resistentes aos antibióticos.
Agora, uma equipe internacional de pesquisadores encontrou uma nova maneira de investigar como a bactéria Tb inativa uma importante família de antibióticos:eles observaram o processo em ação pela primeira vez usando um laser de elétrons livres de raios-X, ou XFEL.
Em experimentos no Laboratório Nacional do Acelerador SLAC do Departamento de Energia, eles misturaram um antibiótico com uma enzima chamada beta-lactamase que a bactéria Tb usa, e então assisti em tempo real enquanto a enzima atacava o antibiótico para desativá-lo.
O método dos pesquisadores, chamada de cristalografia serial mix-and-inject, tira proveito do brilhante, pulsos ultrarrápidos produzidos pela Linac Coherent Light Source (LCLS) da SLAC. Instantâneos de raios-X tirados 30 milissegundos a 2 segundos após o início da reação mostraram ligação da lactamase ao antibiótico, ceftriaxona, e rompendo uma de suas ligações químicas.
Os resultados do experimento foram publicados hoje em BMC Biology .
"Este estudo de prova de conceito mostra que somos capazes de ver a forma e os estágios intermediários das moléculas durante o processo, "diz Marius Schmidt, um professor da Universidade de Wisconsin Milwaukee que liderou o experimento. "Depois de décadas tentando outras técnicas no campo da cristalografia, a tecnologia está aqui. "
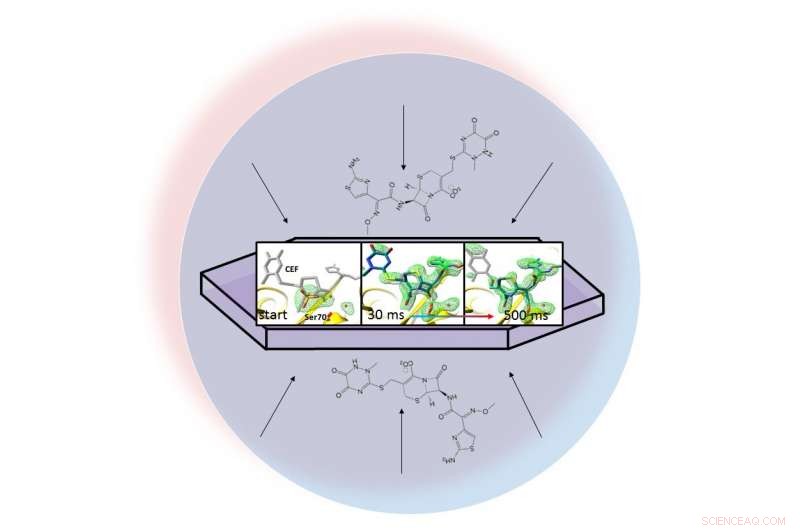
Em uma gota líquida (representada pelo círculo azul claro), um antibiótico se dispersa através de uma proteína cristalizada, beta-lactamase, e se liga a ele. Instantâneos de raios-X do par ligado permitiram aos pesquisadores criar mapas da densidade de elétrons (verde) e observar um anel do antibiótico se abrir (extrema direita) 30 a 500 milissegundos após o início da reação. Crédito:Marius Schmidt / University of Wisconsin Milwaukee
Na cristalografia, cientistas formam um cristal a partir de muitas cópias de uma proteína e atingem o cristal com raios-X para produzir um padrão de difração em um detector, que revela a estrutura atômica da proteína. Essa estrutura é a chave para entender como as enzimas e outras proteínas funcionam.
No passado, isso só funcionava com cristais relativamente grandes, que têm valor limitado neste método porque a solução contendo o antibiótico levaria muito tempo para se difundir no cristal e reagir com a enzima. É importante que a difusão seja mais rápida do que a reação, de modo que as muitas moléculas de proteína no cristal iniciam o processo químico juntas.
Mas LCLS e outros XFELs têm feixes tão intensos que podem capturar padrões de difração de cristais muito menores, um milionésimo de metro ou menos, Schmidt disse, para que o antibiótico possa chegar à enzima rapidamente, e a reação pode ser registrada com raios-X.
"Embora tenha havido estudos elegantes para observar os movimentos das proteínas com alterações induzidas pela luz, nosso trabalho ilustra que uma classe maior de proteínas, ou seja, enzimas, pode ser investigado de forma resolvida no tempo em LCLS e outros XFELs, "diz Jose Olmos, estudante de doutorado na Rice University, um dos principais autores da publicação.
Neste estudo, a equipe de pesquisa entregou minúsculos cristais de beta-lactamase enquanto os misturava com o antibiótico apenas frações de segundo antes de serem atingidos por pulsos de raios-X.
Crédito CC0:domínio público
A equipe tirou milhões de instantâneos de raios-X durante a reação e os costurou para criar um mapa que mostra as mudanças na estrutura tridimensional do antibiótico conforme ele interage com a enzima em temperatura ambiente.
"Para biólogos estruturais, é assim que aprendemos exatamente como a biologia funciona, "diz Mark Hunter, cientista da equipe do SLAC e coautor do estudo. "Nós deciframos a estrutura de uma molécula em um determinado momento, e nos dá uma ideia melhor de como a molécula funciona. "
Em experiências futuras, tirar ainda mais instantâneos durante o curso da reação pode fornecer mais detalhes sobre a estrutura e o comportamento químico da lactamase. Com mais informações, os cientistas poderiam manipular o projeto de antibióticos para prevenir tais ataques. O método experimental também pode ser aplicado para aprender os detalhes de outros tipos de processos biológicos onde as enzimas iniciam ou conduzem as reações.
"Há um grande entusiasmo em relação a esse método, porque abre este novo domínio do tempo para biólogos estruturais, "Hunter diz. Trabalhos anteriores usando esta técnica capturaram a inversão de um interruptor de RNA", "importante para estudos sobre retrovírus e câncer.
Os cientistas planejam usar o método para analisar antibióticos adicionais. Eles também pretendem tirar vantagem das taxas de repetição mais altas - disparos mais rápidos de pulsos de raios-X - esperadas em uma futura atualização do LCLS e no recentemente inaugurado XFEL europeu. Isso permitirá que os cientistas capturem os dados de que precisam em apenas alguns minutos, em comparação com os dias. Eles também podem tirar instantâneos mais espaçados das reações, o que poderia dar uma imagem ainda mais completa da química rápida enquanto ela acontece.