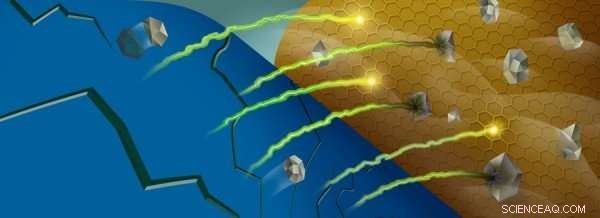
Quando os íons de manganês (cinza) são retirados do cátodo de uma bateria (azul), eles podem reagir com o eletrólito da bateria perto do ânodo (ouro), captura de íons de lítio (verde / amarelo). Crédito:Robert Horn / Argonne National Laboratory
Gosto de voce, eu e todos que conhecemos, as baterias têm uma vida útil finita.
Quando uma bateria entra na "velhice, "os cientistas se referem ao seu desempenho diminuído como" enfraquecimento da capacidade, "em que a quantidade de carga que uma bateria pode fornecer diminui com o uso repetido. O enfraquecimento da capacidade é a razão pela qual uma bateria de telefone celular que costumava durar um dia inteiro, depois de alguns anos, durar talvez apenas algumas horas.
Mas e se os cientistas pudessem reduzir essa perda de capacidade, permitindo que as baterias envelheçam com mais elegância?
"Agora que conhecemos os mecanismos por trás do aprisionamento de íons de lítio e do enfraquecimento da capacidade, podemos encontrar métodos para resolver o problema. "
Pesquisadores do Laboratório Nacional de Argonne do Departamento de Energia dos EUA (DOE) identificaram um dos principais culpados no desbotamento da capacidade de baterias de íon-lítio de alta energia em um artigo publicado no The Journal of the Electrochemical Society.
Para uma bateria de íon de lítio - o tipo que usamos em laptops, smartphones, e veículos elétricos híbridos plug-in - a capacidade da bateria está ligada diretamente à quantidade de íons de lítio que podem ser transportados para frente e para trás entre os dois terminais da bateria conforme ela é carregada e descarregada.
Este vaivém é ativado por certos íons de metal de transição, que mudam os estados de oxidação à medida que os íons de lítio entram e saem do cátodo. Contudo, à medida que a bateria é ciclada, alguns desses íons - principalmente o manganês - são arrancados do material do cátodo e acabam no ânodo da bateria.
Uma vez perto do ânodo, esses íons metálicos interagem com uma região da bateria chamada de interfase de eletrólito sólido, que se forma por causa das reações entre o ânodo altamente reativo e o eletrólito líquido que carrega os íons de lítio para frente e para trás. Para cada molécula de eletrólito que reage e se decompõe em um processo chamado redução, um íon de lítio fica preso na interfase. À medida que mais e mais lítio fica preso, a capacidade da bateria diminui.
Algumas moléculas nesta interfase são reduzidas de forma incompleta, o que significa que eles podem aceitar mais elétrons e amarrar ainda mais íons de lítio. Essas moléculas são como isca, esperando uma faísca.
Quando os íons de manganês são depositados nesta interfase, eles agem como uma faísca acendendo o pavio:esses íons são eficientes em catalisar reações com as moléculas incompletamente reduzidas, aprisionando mais íons de lítio no processo.
"Há uma correlação estrita entre a quantidade de manganês que chega ao ânodo e a quantidade de lítio que fica preso, "disse o co-autor do estudo e cientista de Argonne, Daniel Abraham." Agora que conhecemos os mecanismos por trás do aprisionamento de íons de lítio e do enfraquecimento da capacidade, podemos encontrar métodos para resolver o problema. "