Engenheiros desenvolvem novo método para fabricação de células CAR T usando nanopartículas lipídicas
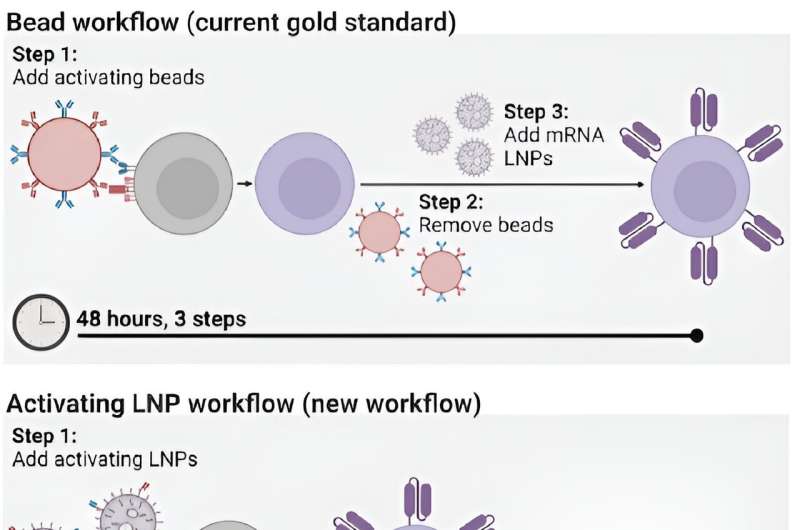 Usar nanopartículas lipídicas ativadoras (aLNPs) para criar células T CAR requer menos etapas e menos tempo. Crédito:Materiais Avançados (2024). DOI:10.1002/adma.202313226
Usar nanopartículas lipídicas ativadoras (aLNPs) para criar células T CAR requer menos etapas e menos tempo. Crédito:Materiais Avançados (2024). DOI:10.1002/adma.202313226 Para pacientes com certos tipos de câncer, a terapia com células T CAR tem sido nada menos que uma mudança de vida. Desenvolvida em parte por Carl June, Richard W. Vague Professor da Perelman School of Medicine, e aprovada pela Food and Drug Administration (FDA) em 2017, a terapia com células T CAR mobiliza o sistema imunológico dos próprios pacientes para combater o linfoma e a leucemia, entre outros tipos de câncer.
No entanto, o processo de fabricação das próprias células CAR T é demorado e caro, exigindo várias etapas ao longo dos dias. O processo envolve a extração de células T dos pacientes e sua ativação com pequenas esferas magnéticas, antes de dar às células T instruções genéticas para produzirem receptores de antígenos quiméricos (CARs), os receptores especializados que ajudam as células T a eliminar as células cancerígenas.
Agora, os engenheiros da Penn desenvolveram um novo método para fabricar células T CAR, que leva apenas 24 horas e requer apenas uma etapa, graças ao uso de nanopartículas lipídicas (LNPs), os potentes veículos de entrega que desempenharam um papel crítico na Moderna. e vacinas Pfizer-BioNTech COVID-19.
Em um novo artigo publicado na Advanced Materials, Michael J. Mitchell, professor associado de bioengenharia, descreve a criação de "nanopartículas lipídicas ativadoras" (aLNPs), que podem ativar células T e entregar as instruções genéticas para CARs em uma única etapa, muito simplificando o processo de fabricação de células CAR T.
“Queríamos combinar essas duas áreas de pesquisa extremamente promissoras”, diz Ann Metzloff, estudante de doutorado e pesquisadora de pós-graduação no laboratório Mitchell e autora principal do artigo. “Como poderíamos aplicar nanopartículas lipídicas à terapia com células T CAR?”
De certa forma, as células T funcionam como uma unidade militar de reserva:em tempos de saúde, permanecem inactivas, mas quando detectam agentes patogénicos, mobilizam-se, expandindo rapidamente o seu número antes de se voltarem para enfrentar a ameaça. O cancro representa um desafio único a esta estratégia de defesa. Como as células cancerosas são do próprio corpo, as células T não tratam automaticamente o câncer como perigoso, daí a necessidade de primeiro “ativar” as células T e entregar CARs de detecção de câncer na terapia com células T CAR.
Até agora, o meio mais eficiente de activar as células T tem sido extraí-las da corrente sanguínea de um paciente e depois misturar essas células com esferas magnéticas ligadas a anticorpos específicos – moléculas que provocam uma resposta imunitária. “As contas são caras”, diz Metzloff. "Eles também precisam ser removidos com um ímã antes que você possa administrar clinicamente as células T. No entanto, ao fazer isso, você também perde muitas células T."
Feitas principalmente de lipídios, as mesmas moléculas repelentes de água que constituem as gorduras de cozinha doméstica, como manteiga e azeite, as nanopartículas lipídicas provaram ser tremendamente eficazes no fornecimento de delicadas cargas moleculares. Seu formato semelhante a uma cápsula pode envolver e proteger o mRNA, que fornece instruções para as células fabricarem proteínas. Devido ao uso generalizado das vacinas contra a COVID-19, diz Metzloff, “a segurança e a eficácia das nanopartículas lipídicas foram demonstradas em milhares de milhões de pessoas em todo o mundo”.
Para incorporar LNPs na produção de células T CAR, Metzloff e Mitchell se perguntaram se seria possível anexar os anticorpos ativadores usados nas esferas magnéticas diretamente à superfície dos LNPs. Eles pensaram que empregar LNPs dessa forma poderia tornar possível eliminar completamente a necessidade de ativação de esferas no processo de produção. “Isso é uma novidade”, diz Metzloff, “porque estamos usando nanopartículas lipídicas não apenas para entregar mRNA que codifica CARs, mas também para iniciar um estado de ativação vantajoso”.
Ao longo de dois anos, Metzloff otimizou cuidadosamente o projeto dos aLNPs. Um dos principais desafios foi encontrar a proporção certa de um anticorpo para outro. “Havia muitas escolhas a fazer”, lembra Metzloff, “já que isso nunca havia sido feito antes”.
Ao anexar os anticorpos diretamente às LNPs, os pesquisadores conseguiram reduzir o número de etapas envolvidas no processo de fabricação de células T CAR de três para uma, e reduzir pela metade o tempo necessário, de 48 horas para apenas 24 horas. “Esperamos que isso tenha um efeito transformador no processo de fabricação de células T CAR”, diz Mitchell. “Atualmente, leva muito tempo para fabricá-los e, portanto, não são acessíveis a muitos pacientes em todo o mundo que precisam deles”.
As células CAR T fabricadas com aLNPs ainda não foram testadas em humanos, mas em modelos de camundongos, as células CAR T criadas usando o processo descrito no artigo tiveram um efeito significativo na leucemia, reduzindo o tamanho dos tumores, demonstrando assim a viabilidade da tecnologia .
Metzloff também vê potencial adicional para aLNPs. “Acho que os aLNPs poderiam ser explorados de forma mais ampla como uma plataforma para entregar outras cargas às células T”, diz ela. "Demonstramos neste artigo uma aplicação clínica específica, mas as nanopartículas lipídicas podem ser usadas para encapsular muitas coisas diferentes:proteínas, diferentes tipos de mRNA. Os aLNPs têm ampla utilidade potencial para a terapia do câncer de células T como um todo, além deste mRNA Aplicação de células CAR T que mostramos aqui."
