 Canto superior esquerdo:Distribuição de vacinas, "mRNA nu" e "mRNA envolto em uma camada lipídica". Crédito:Satoshi Uchida
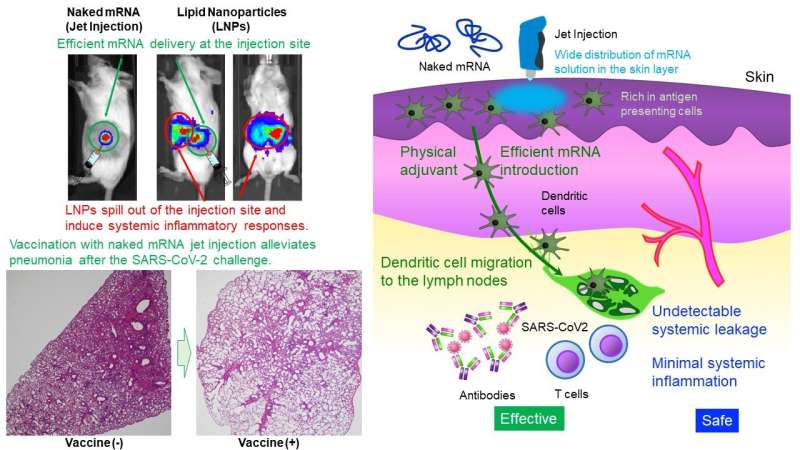
Canto superior esquerdo:Distribuição de vacinas, "mRNA nu" e "mRNA envolto em uma camada lipídica". Crédito:Satoshi Uchida O Laboratório Uchida do Centro de Inovação de NanoMedicina demonstrou que a administração intradérmica apenas de mRNA (mRNA nu) sem proteção por nanopartículas induziu vacinação robusta contra SARS CoV-2, um vírus que causa COVID-19, em camundongos e primatas. O mRNA é altamente instável, geralmente considerado como exigindo uma cápsula minúscula, como nanopartículas lipídicas (LNPs), para administração.
O método aqui relatado é a primeira vacina de mRNA nu que demonstra prevenção contra SARS-CoV-2. Sem utilizar LNPs, que têm grande probabilidade de causar eventos adversos sistémicos, esta vacina pode permitir doses repetidas. Agora está em desenvolvimento para ensaios clínicos. Os resultados detalhados da pesquisa serão publicados em Terapia Molecular .
Durante a pandemia de COVID-19, as vacinas de mRNA demonstraram uma eficácia notável, com milhares de milhões de doses administradas em todo o mundo. No entanto, surgiram desafios no meio do seu rápido desenvolvimento, nomeadamente no que diz respeito a reações adversas relativamente fortes, incluindo as graves, que continuam a ser problemas significativos.
Embora estas reações adversas possam ser consideradas aceitáveis para um número limitado de doses durante uma pandemia, é desejável uma plataforma mais segura que permita doses múltiplas ao longo da vida para reforços contínuos da COVID-19 e para a extensão da aplicação da vacina de mRNA a outras doenças infecciosas. As atuais vacinas de mRNA têm sido associadas a reações adversas, atribuídas principalmente a nanopartículas lipídicas (LNPs) que transportam o mRNA (mRNA envolto em um revestimento lipídico).
Os LNPs possuem propriedades imunoestimulantes e podem sair do local da injeção, levando a respostas inflamatórias sistêmicas. No entanto, os LNPs desempenham papéis cruciais na eficácia da vacina, como a [Função I] prevenindo a degradação do mRNA e entregando eficientemente o mRNA às células, a [Função II] migrando para os gânglios linfáticos para entregar o mRNA às células imunológicas e a [Função III] estimulando o sistema imunológico. através de lipídios imunoestimulantes. O presente estudo visa obter essas funções sem depender de LNPs.
Este estudo fornece um projeto simples e seguro, a administração de mRNA nu. Em relação à [Função II], poucas células imunológicas residem no tecido muscular, um local atual de administração de vacinas de mRNA. Portanto, o tecido da pele, que é mais abundante em células do sistema imunológico, foi o alvo.
Além disso, para a [Função I], a equipe de pesquisa usou um Jet Injector que facilita a entrega de mRNA às células da pele utilizando estresse físico induzido pelo fluxo do jato. Em um estudo de repórter, o Jet Injector melhorou a eficiência de entrega de mRNA em mais de 100 vezes em comparação com uma injeção convencional com agulha e seringa. Além disso, o mRNA permaneceu no local da injeção sem vazamento sistêmico detectável.
 Jet Injector usado para injeção de "Naked mRNA" Crédito:Satoshi Uchida
Jet Injector usado para injeção de "Naked mRNA" Crédito:Satoshi Uchida
Por outro lado, LNPs carregados com mRNA (mRNA envolto em uma camada lipídica) migraram para o fígado, baço e outros órgãos sistêmicos após administração intradérmica, provocando inflamações ali. Além disso, a inflamação no local da injeção foi muito pequena no nosso método, enquanto o mRNA revestido por um revestimento lipídico induziu infiltração de células inflamatórias e necrose tecidual.
Em seguida, a equipe de pesquisa demonstrou pela primeira vez a capacidade de vacinação do mRNA nu usando um antígeno modelo. O injetor a jato melhorou drasticamente a eficácia da produção de anticorpos para um nível comparável ao do mRNA revestido por um revestimento lipídico nas doses máximas toleráveis.
Esses anticorpos combatem os vírus no corpo, prevenindo a infecção, mas não conseguem remover as células infectadas. Por outro lado, a imunidade celular remove essas células doentes, desempenhando um papel crítico na prevenção de doenças graves. Curiosamente, a vacina de mRNA nu aumenta efetivamente o número de imunócitos, como células T positivas para CD4 e células T positivas para CD8.
Em seguida, a equipe de pesquisa conduziu experimentos de desafio viral após a vacinação com mRNA nu visando a proteína spike do vírus SARS-CoV-2. A vacinação reduziu significativamente a quantidade de vírus nos pulmões e aliviou a inflamação pulmonar em comparação com um controlo não vacinado. Esta vacina proporcionou aos macacos cynomolgus uma eficácia vacinal comparável à dos ratos, sem reações adversas significativas.
O presente estudo também inclui análises mecanísticas. Em relação à [Função II], a vacina de mRNA nu permaneceu no local da injeção e não migrou para os gânglios linfáticos. Por outro lado, as células apresentadoras de antígenos que captaram o mRNA no local da injeção migraram para os gânglios linfáticos, o que pode contribuir para a eficácia da vacinação.
Na verdade, a vacina induziu a maturação do linfonodo próximo ao local da injeção. Para a [Função III], o Jet Injector causou inflamação transitória localizada no local da injeção, recrutando linfócitos. A injeção de mRNA nu com agulha e seringa não induziu tal resposta inflamatória. Estes resultados sugerem que a estimulação imunológica pelo Jet Injector pode funcionar como um adjuvante físico para aumentar a eficácia da vacinação. As reações inflamatórias locais observadas desapareceram em poucos dias.
Em conclusão, a vacina de mRNA nu reduz as reações adversas sistémicas, um problema com o mRNA envolto num revestimento lipídico, e induz imunidade suficiente para a proteção contra doenças infecciosas. Esta é uma conquista líder mundial na prevenção de doenças infecciosas apenas com mRNA. Na prática, esta vacina pode tornar-se uma plataforma que permite doses repetidas com reações adversas menores. Atualmente estão sendo realizados mais estudos, com o objetivo de um ensaio clínico previsto para 2026.

