Nova abordagem usa proteínas camufladas para fornecer terapias que matam o câncer nas células
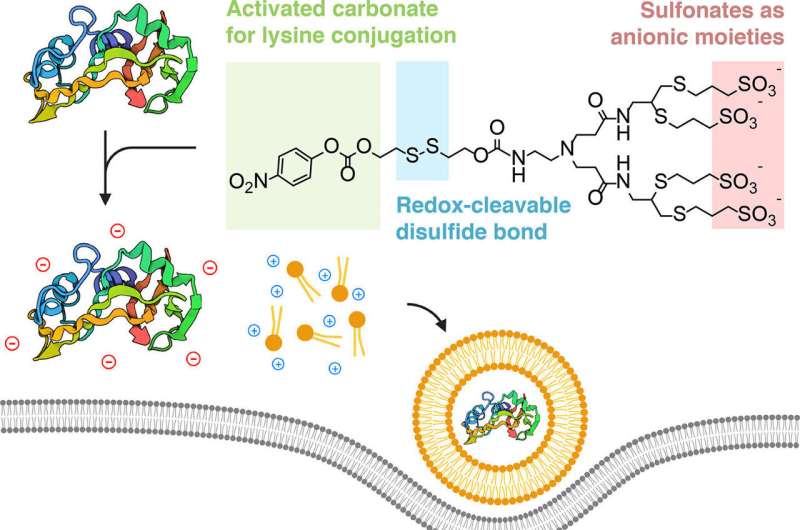 Esquema da estratégia de camuflagem aniônica biorreversível. A modificação química de lisinas expostas à superfície com reagentes de camuflagem sulfonados permite a complexação e subsequente entrega de cargas proteicas com lipídios catiônicos. Após o escape endocítico, os reagentes são clivados através da presença de uma ligação dissulfeto autoimolativa e sensível a redox para entregar sem deixar vestígios a proteína de carga no citoplasma de uma célula. Crédito:ACS Central Science (2024). DOI:10.1021/acscentsci.4c00071
Esquema da estratégia de camuflagem aniônica biorreversível. A modificação química de lisinas expostas à superfície com reagentes de camuflagem sulfonados permite a complexação e subsequente entrega de cargas proteicas com lipídios catiônicos. Após o escape endocítico, os reagentes são clivados através da presença de uma ligação dissulfeto autoimolativa e sensível a redox para entregar sem deixar vestígios a proteína de carga no citoplasma de uma célula. Crédito:ACS Central Science (2024). DOI:10.1021/acscentsci.4c00071 Uma colaboração interdisciplinar desenvolveu uma forma de “ocultar” as proteínas para que possam ser capturadas por nanopartículas lipídicas, que são semelhantes a pequenas bolhas de gordura. Estas bolhas são suficientemente pequenas para infiltrar a sua carga oculta nas células vivas, onde as proteínas se revelam e exercem o seu efeito terapêutico.
A técnica generalizável poderia levar ao reaproveitamento de milhares de produtos proteicos comerciais, incluindo anticorpos, para pesquisas biológicas e aplicações terapêuticas.
O artigo do grupo, "Bioreversible Anionic Cloaking Enables Intracelular Protein Delivery with Ionizable Lipid Nanoparticles", publicado em 14 de maio na ACS Central Science . O autor principal é o estudante de doutorado Azmain Alamgir, que trabalha nos laboratórios dos co-autores seniores do artigo, Chris Alabi, professor associado de engenharia química e biomolecular na Cornell Engineering, e Matt DeLisa, professor de engenharia William L. Lewis e diretor do Instituto Cornell de Biotecnologia.
O projeto começou com um objetivo único:combinar a experiência do grupo DeLisa na concepção de terapêuticas baseadas em proteínas com o foco do laboratório Alabi na entrega intracelular de produtos biológicos.
Para que alguns medicamentos tenham impacto na biologia de uma célula e, em última análise, tratem doenças, eles precisam entrar na célula e atingir um espaço específico. Isso é semelhante a consertar um cano quebrado em uma casa:o encanador precisa acessar um cômodo específico para consertar o vazamento.
A terapêutica baseada em proteínas tem muitas virtudes – podem ter efeitos mais específicos, com menor toxicidade e menor resposta imunitária – mas a facilidade de administração não é uma delas. As proteínas são grandes e pesadas e não se difundem livremente nas células com a mesma facilidade que as moléculas pequenas. Essa é uma das razões pelas quais as moléculas pequenas são a fonte predominante de medicamentos na indústria farmacêutica:elas podem difundir-se facilmente nas células sem um veículo de entrega.
Ao longo dos anos, o grupo de DeLisa desenvolveu uma ampla gama de candidatos a medicamentos proteicos interessantes e potencialmente eficazes. Infelizmente, a utilidade prática destas proteínas foi limitada pela ausência de um método para distribuição intracelular. Embora a terapia genética – uma tecnologia biomédica que pode produzir um efeito terapêutico ao entregar um gene para expressão em células-alvo – fosse uma opção, o método tem uma história conturbada, devido a questões de segurança em humanos.
“Estávamos procurando uma maneira inteligente de colocar com eficiência nossas proteínas projetadas dentro das células, especialmente em um contexto translacional que não funcionasse apenas em células cultivadas em laboratório, mas que também fosse eficaz e seguro em modelos animais e, eventualmente, em humanos. ", disse DeLisa.
“Quando Azmain conectou nosso grupo com o grupo de Chris, uma das ideias que surgiram foi:por que entregar isso como uma terapia genética quando poderíamos entregá-lo como uma proteína já produzida?
O laboratório de Alabi vinha enfrentando seus próprios desafios. Embora a equipe tivesse experiência em fornecer ácidos nucléicos em células usando nanopartículas, disse Alabi, eles ainda não tinham encontrado uma maneira de fazer o mesmo com "proteínas moles e globulares" devido à experiência limitada do laboratório na produção de quantidades suficientes de proteínas para testes.
“Vimos isso como uma boa ponte entre nossos grupos de pesquisa, para criar esse novo espaço no qual não acho que muitas pessoas estavam trabalhando na época e fazê-lo de uma forma que pudesse ser escalonável e impactante”, disse Alabi. .
Os pesquisadores tiveram a ideia ampla de usar uma abordagem de bioconjugação que permitiria que as proteínas fossem carregadas em nanopartículas lipídicas, que se formam em torno dos ácidos nucléicos. Uma grande vantagem desta abordagem foi que as nanopartículas lipídicas foram um componente chave nas vacinas contra a COVID-19 bem-sucedidas desenvolvidas pela Pfizer-BioNTech e Moderna.
“Na época, essa tecnologia estava realmente decolando”, disse Alamgir.
Essas vacinas funcionaram entregando uma carga útil na forma de RNA mensageiro, que são ácidos nucléicos. Os pesquisadores agora usariam o mesmo conceito de entrega de nanopartículas lipídicas – até mesmo os mesmos materiais – mas com uma carga útil de proteína. O truque seria fazer com que as proteínas se parecessem mais com ácidos nucléicos.
Os pesquisadores descobriram que poderiam conseguir isso “cobrindo” as proteínas com um íon carregado negativamente, de modo que elas se unissem eletrostaticamente aos lipídios carregados positivamente.
“O cerne da nossa estratégia é conceitualmente muito simples”, disse Alamgir. “Estamos pegando proteínas e remodelando especificamente suas superfícies com cargas negativas, para que se pareçam com ácidos nucléicos e possam se agrupar de forma semelhante em nanopartículas quando formuladas com os lipídios característicos”.
Uma dificuldade que a equipa encontrou foi que as condições sob as quais os ácidos nucleicos são formulados para se juntarem, ou complexarem, com os lípidos são bastante duras – demasiado duras para as proteínas.
“Tivemos que usar condições mais suaves e uma formulação ligeiramente modificada onde adicionamos lipídios extras”, disse Alabi. “Portanto, tanto do lado da bioconjugação de proteínas quanto do lado lipídico, tivemos que ajustar a formulação para que isso funcionasse tão bem”.
A equipe, que incluiu o estudante de doutorado e coautor Souvik Ghosal, demonstrou com sucesso o método de camuflagem com compostos sulfonados reativos à lisina, matando células cancerígenas com ribonuclease A e inibindo a sinalização tumoral com anticorpos monoclonais de imunoglobulina G (IgG).
Um benefício adicional da química de bioconjugação utilizada pela equipe é que o processo é reversível. A etiqueta química adicionada à proteína se desprende assim que entra no citoplasma da célula. E como o método de bioconjugação tem como alvo a lisina – um tipo de aminoácido abundantemente encontrado em proteínas naturais – a técnica pode ser replicada para praticamente qualquer proteína.
“Isso tem potencial para pegar muitas proteínas disponíveis no mercado que estão atualmente disponíveis em muitos distribuidores de ciências biológicas e empresas de biotecnologia e redirecioná-las para novas aplicações intracelulares”, disse Alamgir.
