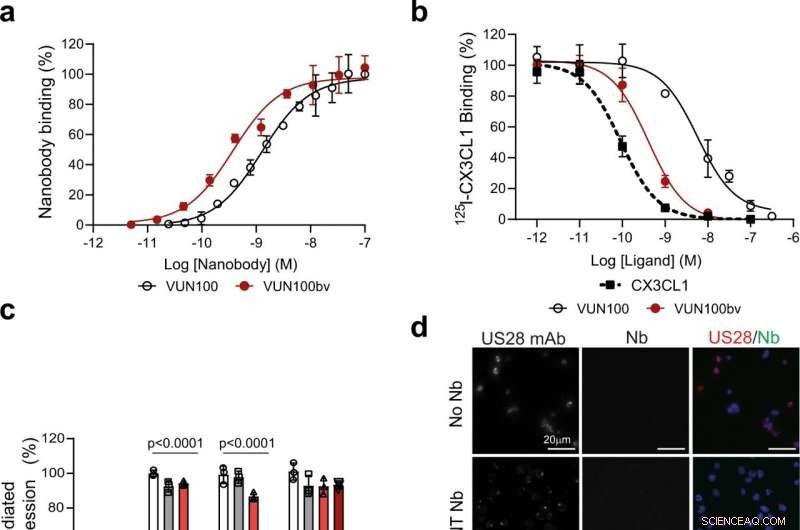
Fig. 1:VUN100bv se liga e inibe a sinalização de US28. uma Ligação por ELISA de VUN100 monovalente e VUN100bv bivalente a extratos de membrana de células HEK293T que expressam US28. Figura representativa de três experimentos independentes. b Deslocamento de 125I-CX3CL1 de membranas que expressam US28 por ligante não marcado ou os nanocorpos VUN100 e VUN100bv. Figura representativa de três experimentos independentes. c Efeito de nanocorpos na ativação de NFAT (fator nuclear de células T ativadas) mediada por US28. Células HEK293T que expressam apenas repórter NFAT-luciferase (Mock) ou repórter NFAT-luciferase juntamente com o receptor de tipo selvagem US28 (WT), Mutante US28 Y16F (Y16F), Mutante US28 ΔN (2–22) (ΔN (2–22)) ou mutante US28 R129A (R129A). As células não foram tratadas (untr) ou tratadas com um nanocorpo não direcionado (NT Nb), VUN100, ou VUN100bv por 24 h antes da medição de luminescência. Os dados foram normalizados para as amostras de WT não tratadas. Figura representativa de três experimentos independentes. d Microscopia de imunofluorescência de nanocorpo ligando-se a células THP-1 que expressam US28. US28 foi detectado usando um anticorpo policlonal de coelho anti-US28 (US28 mAb). As células foram incubadas sem nanocorpo (No Nb), um NT Nb, VUN100, ou VUN100bv. O nanocorpo ligado foi detectado usando o marcador Myc presente nos nanocorpos e um anticorpo anti-Myc (Nb). Figura representativa de três experimentos independentes. e Detecção de Western blot para níveis totais de IFI16 de lisados de células THP-1 não tratadas com transdução simulada (THP-1 Mock) ou células THP-1 expressando US28 (THP-1 US28 WT). Células THP-1 US28 WT não foram tratadas (Untr) ou tratadas com NT Nb, VUN100, ou VUN100bv por 48 h. Os níveis de proteína IFI16 foram determinados e normalizados para os níveis de proteína actina. Os níveis relativos da proteína IFI16 foram normalizados para lisados de células simuladas de THP-1 não tratados. n =3 experimentos independentes de três réplicas biológicas independentes. Todos os dados são representados graficamente como média ± D.P. Para todos os dados, exceto para a Fig. 1c, as análises estatísticas foram realizadas usando um teste t bicaudal desemparelhado. Para a Fig. 1c, a significância estatística foi determinada pelo método Holm-Sidak (bilateral com alfa =0,05). Os dados de origem são fornecidos como um arquivo de dados de origem. Crédito:DOI:10.1038 / s41467-021-24608-5
Os cientistas desenvolveram um "nanocorpo" - um pequeno fragmento de um anticorpo de lhama - que é capaz de expulsar o citomegalovírus humano (HCMV) à medida que se esconde do sistema imunológico. Isso permite que as células do sistema imunológico busquem e destruam esse vírus potencialmente mortal.
Acredita-se que cerca de quatro em cada cinco pessoas no Reino Unido estejam infectadas com HCMV, e nos países em desenvolvimento pode chegar a 95%. Para a maioria das pessoas, o vírus permanece dormente, escondido dentro dos glóbulos brancos, onde pode permanecer inalterado e não detectado por décadas. Se o vírus for reativado em um indivíduo saudável, geralmente não causa sintomas. Contudo, para pessoas imunocomprometidas, por exemplo, receptores de transplantes que precisam tomar drogas imunossupressoras para prevenir a rejeição de órgãos - a reativação do HCMV pode ser devastadora.
Atualmente, não há vacina eficaz contra HCMV, e os medicamentos antivirais freqüentemente se mostram ineficazes ou têm efeitos colaterais muito sérios.
Agora, em um estudo publicado em Nature Communications , pesquisadores da Vrije Universiteit Amsterdam na Holanda e da Universidade de Cambridge descobriram uma maneira de perseguir o vírus de seu esconderijo usando um tipo especial de anticorpo conhecido como nanocorpo.
Os nanocorpos foram identificados pela primeira vez em camelos e existem em todos os camelídeos - uma família de animais que também inclui dromedários, lhamas e alpacas. Os anticorpos humanos consistem em duas cadeias pesadas e duas leves de moléculas, que juntos reconhecem e se ligam a marcadores na superfície de uma célula ou vírus conhecidos como antígenos. Para esta classe especial de anticorpos camelídeos, Contudo, apenas um único fragmento do anticorpo - muitas vezes referido como anticorpo de domínio único ou nanocorpo - é suficiente para reconhecer os antígenos de maneira adequada.
Dr. Timo De Groof da Vrije Universiteit Amsterdam, o primeiro autor conjunto do estudo, disse:"Como o nome sugere, os nanocorpos são muito menores do que os anticorpos normais, o que os torna perfeitamente adequados para determinados tipos de antígenos e relativamente fáceis de fabricar e ajustar. É por isso que eles estão sendo aclamados como tendo o potencial de revolucionar as terapias de anticorpos. "
O primeiro nanocorpo foi aprovado e introduzido no mercado pela empresa biofarmacêutica Ablynx, enquanto outros nanocorpos já estão em testes clínicos para doenças como artrite reumatóide e certos tipos de câncer. Agora, a equipe da Holanda e do Reino Unido desenvolveu nanocorpos que têm como alvo uma proteína específica do vírus (US28), um dos poucos elementos detectáveis na superfície de uma célula com infecção latente de HCMV e um dos principais motores desse estado latente.
O Dr. Ian Groves, do Departamento de Medicina da Universidade de Cambridge, disse:"Nossa equipe mostrou que nanocorpos derivados de lhamas têm o potencial de superar o citomegalovírus humano. Isso pode ser muito importante, pois o vírus pode causar complicações fatais em pessoas cujos o sistema imunológico não está funcionando adequadamente. "
Em experimentos de laboratório usando sangue infectado com o vírus, a equipe mostrou que o nanocorpo se liga à proteína US28 e interrompe os sinais estabelecidos pela proteína que ajudam a manter o vírus em seu estado dormente. Uma vez que este controle é quebrado, as células imunes locais são capazes de "ver" se a célula está infectada, habilitando as células imunológicas do hospedeiro a caçar e matar o vírus, purgando o reservatório latente e limpando o sangue do vírus.
Dra. Elizabeth Elder, primeiro autor em conjunto, que realizou seu trabalho enquanto na Universidade de Cambridge, disse:"A beleza desta abordagem é que ela reativa o vírus apenas o suficiente para torná-lo visível para o sistema imunológico, mas não o suficiente para fazer o que um vírus normalmente faz - se replicar e se espalhar. O vírus é forçado a colocar sua cabeça acima do parapeito, onde pode ser morto pelo sistema imunológico. "
Professora Martine Smit, também da Vrije Universiteit Amsterdam, acrescentou:"Acreditamos que nossa abordagem pode levar a um novo tipo de tratamento muito necessário para reduzir - e potencialmente até prevenir - o CMV infeccioso em pacientes elegíveis para transplantes de órgãos e células-tronco."