Diversas estruturas amilóides e dinâmicas reveladas por microscopia de força atômica de alta velocidade
 p Crédito:Unsplash / CC0 Public Domain
p Crédito:Unsplash / CC0 Public Domain
p No corpo humano, as proteínas às vezes ocorrem em agregados fibrilares chamados amiloides. Embora certos amilóides sejam conhecidos por terem uma função biológica, a formação de amiloide é frequentemente associada a patologias, incluindo doenças de Alzheimer e Parkinson. Entender como exatamente as fibrilas amilóides se formam é crucial para obter insights sobre o desenvolvimento dessas doenças e para avançar nas abordagens de tratamento. p Agora, Takahiro Watanabe-Nakayama da Kanazawa University, Kenjiro Ono da Showa University, e colegas investigaram o processo de formação de fibrilas amiloides particulares usando uma técnica que permite a visualização do crescimento ao longo do tempo. Os cientistas analisaram especificamente o efeito da semeadura cruzada ('mistura') de diferentes proteínas formando agregados, e encontraram variações nas taxas de alongamento e nas estruturas das fibrilas.
p Os pesquisadores estudaram alfa-sinucleína, uma proteína abundante no cérebro humano. Eles analisaram o que aconteceu ao permitir que as moléculas de alfa-sinucleína de tipo selvagem - as naturais, variante mais abundante - agregados de forma, e também como a agregação é diferente ao introduzir (semeadura cruzada) variantes mutantes associadas à doença de Parkinson. Além disso, os cientistas examinaram a influência do nível de pH do microambiente em que ocorre o crescimento da fibrila.
p Por meio de microscopia de força atômica de alta velocidade (HS-AFM), Watanabe-Nakayama, Ono e colegas puderam registrar a agregação de fibrilas em resolução nanométrica e alta taxa de vídeo para vários casos. Primeiro, os cientistas observaram o crescimento de tipos de variantes únicas (auto-semeadura). Eles descobriram que os mutantes produziram mais agregados, ou que eles agregaram mais rápido em pH neutro do que as variantes do tipo selvagem. Outra observação foi que o alongamento foi mais rápido em pH mais baixo (5,8, isto é, ácido) do que em pH mais alto (7,4, ou seja, básico).
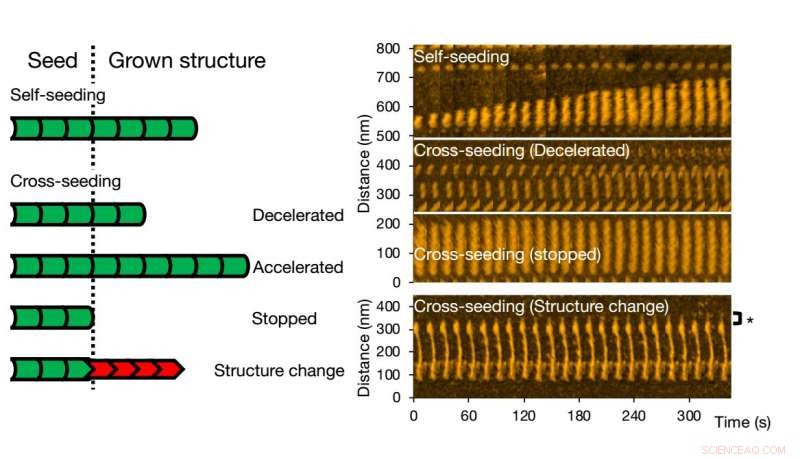 p A microscopia de força atômica de alta velocidade permite visualizar e analisar a formação de fibrilas de variantes de uma única proteína. Crédito:Kanazawa University
p A microscopia de força atômica de alta velocidade permite visualizar e analisar a formação de fibrilas de variantes de uma única proteína. Crédito:Kanazawa University
p Para semeadura cruzada, diferentes cenários podem ocorrer. O crescimento da fibrila pode ser acelerado ou retardado, ou mesmo parado. A morfologia da semente original pode ser preservada, mas também acontece que a estrutura da fibrila resultante é diferente - as formas estruturais típicas são 'retas' ou 'espirais'. Os pesquisadores verificaram que a estrutura e a dinâmica da fibrila, conforme observada com HS-AFM, correspondem aos processos em solução por meio de experimentos de fluorescência; conclusões semelhantes foram obtidas.
p As descobertas de Watanabe-Nakayama, Ono e colegas são relevantes para uma melhor compreensão das doenças relacionadas com a amiloide. Citando os pesquisadores:"A semeadura cruzada combinada com variações nas taxas de alongamento tem o efeito de aumentar a diversidade estrutural dos conjuntos resultantes. Essa diversidade pode ser refletida em efeitos neurotóxicos distintos para vários conjuntos [de proteínas]."

