Teias semelhantes a nanofibras de titânia 3-D baseadas em ionização de plasma para aumentar a biorreatividade e a osteocondutividade de biomateriais
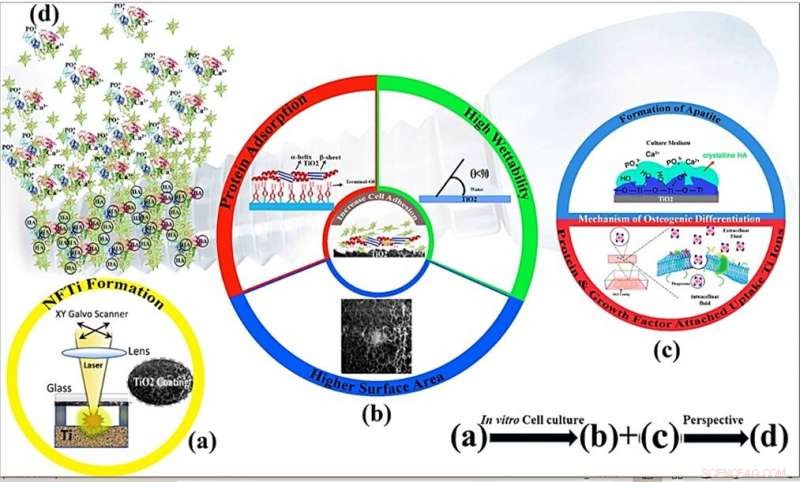 p Mecanismos esquemáticos de proliferação celular e osteoindutividade do revestimento nanofibroso de titânio por modificação de superfície por meio de transferência reversa induzida por laser de alta intensidade (HILIRT):Um novo método de deposição. (a) Camada NFTi depositada no vidro pela técnica HILIRT proposta em velocidades de varredura de feixe de laser. (b) A biocompatibilidade do titânio como um material de implante é atribuída ao óxido de superfície que se forma espontaneamente no ar e / ou fluidos fisiológicos, e acredita-se que os comportamentos celulares, por exemplo., adesão, a propagação e a proliferação são grandemente afetadas por 1. Área de superfície 2. molhabilidade 3. Grupos hidroxila de superfície (Os grupos hidroxila de superfície do terminal OH- regulam os comportamentos iniciais de adsorção de proteína). (c) Grupos hidroxila de superfície e nanopartículas de Ti bioativas promovem a diferenciação de osteoblastos por meio de 1. Os grupos Ti-OH formados na superfície do titanato após imersão em meio de cultura osteogênico são carregados negativamente, e, portanto, combinam-se seletivamente com os íons Ca2 + carregados positivamente no fluido para, eventualmente, formar fosfato de cálcio. 2. Biocomplexos (íons, proteína e fator de crescimento) são internalizados por endocitose mediada por caveolae. (d) Perspectiva:Formação e remodelação óssea em torno dos materiais implantados. Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-54533-z
p Mecanismos esquemáticos de proliferação celular e osteoindutividade do revestimento nanofibroso de titânio por modificação de superfície por meio de transferência reversa induzida por laser de alta intensidade (HILIRT):Um novo método de deposição. (a) Camada NFTi depositada no vidro pela técnica HILIRT proposta em velocidades de varredura de feixe de laser. (b) A biocompatibilidade do titânio como um material de implante é atribuída ao óxido de superfície que se forma espontaneamente no ar e / ou fluidos fisiológicos, e acredita-se que os comportamentos celulares, por exemplo., adesão, a propagação e a proliferação são grandemente afetadas por 1. Área de superfície 2. molhabilidade 3. Grupos hidroxila de superfície (Os grupos hidroxila de superfície do terminal OH- regulam os comportamentos iniciais de adsorção de proteína). (c) Grupos hidroxila de superfície e nanopartículas de Ti bioativas promovem a diferenciação de osteoblastos por meio de 1. Os grupos Ti-OH formados na superfície do titanato após imersão em meio de cultura osteogênico são carregados negativamente, e, portanto, combinam-se seletivamente com os íons Ca2 + carregados positivamente no fluido para, eventualmente, formar fosfato de cálcio. 2. Biocomplexos (íons, proteína e fator de crescimento) são internalizados por endocitose mediada por caveolae. (d) Perspectiva:Formação e remodelação óssea em torno dos materiais implantados. Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-54533-z
p Em um novo estudo publicado em
Relatórios Científicos , Mohammad-Hossein Beigi e uma equipe de pesquisa dos departamentos de Engenharia e Ciência Aplicada e Biotecnologia Celular no Canadá e no Irã descreveram um novo método para formar biomateriais biocompatíveis para engenharia de tecido ósseo. Eles projetaram como a web, revestimentos nanofibrosos de Titânia tridimensionais (3-D) usando transferência reversa induzida por laser de alta intensidade (HILIRT). A equipe demonstrou pela primeira vez o mecanismo de ablação e deposição de titânio (Ti) em substratos de vidro usando pulsos de laser de picossegundos múltiplos no ar ambiente para comparar previsões teóricas com resultados experimentais. Eles examinaram o desempenho de amostras de vidro desenvolvidas pelo revestimento de estruturas nanofibrosas de titânia por meio de durações de pulso de laser variadas, usando métodos como microscopia eletrônica de varredura (MEV). p Para entender as interações entre a superfície do novo material e as células biológicas, Beigi et al. explorou as interações de células-tronco mesenquimais derivadas de osso humano (BMSCs) cultivadas nos novos biomateriais. Por esta, eles usaram uma variedade de testes em laboratório, incluindo um método colorimétrico para entender a atividade metabólica celular (ensaio MTS), imunocitoquímica, adsorção de proteínas e análises de absorção. Os resultados mostraram biocompatibilidade significativamente melhorada em amostras tratadas com laser em comparação com substratos não tratados. Beigi et al. modificaram sua técnica HILIRT diminuindo a duração do pulso e gerando nanofibras de titânia com estruturas mais densas durante a engenharia de materiais avançada. De acordo com suas descobertas, a densidade das nanoestruturas e a concentração de nanofibras revestidas desempenharam um papel crítico para gerar bioatividade nas amostras tratadas, induzindo a diferenciação precoce de BMSCs (células-tronco mesenquimais derivadas de osso) para formar tecido ósseo via diferenciação osteogênica (formação óssea).
p Os bioengenheiros estão desenvolvendo rapidamente novas técnicas de engenharia de tecido ósseo (BTE) para regeneração óssea; para melhorar os "padrões ouro" existentes de autoenxerto ósseo e métodos de aloenxerto na medicina regenerativa. As desvantagens das técnicas existentes incluem morbidade do local doador e suplementos de nutrientes limitados durante a regeneração óssea. A engenharia de tecido ósseo (BTE) é uma direção de pesquisa promissora para facilitar o crescimento e reparo ósseo, mesmo em defeitos esqueléticos em grande escala. Os pesquisadores pretendem usar células-tronco com BTE devido às suas capacidades de auto-renovação juntamente com a diferenciação de células-tronco, para formar uma variedade de tipos de tecido. Uma vez que as propriedades físicas e químicas da superfície de um material podem influenciar a viabilidade das células-tronco mesenquimais humanas (hMSCs) para auto-restauração, diferenciação e proliferação. Materiais e células podem, portanto, trabalhar juntos em aplicações de BTE para fornecer uma plataforma desejada para osseointegração durante a remodelação óssea.
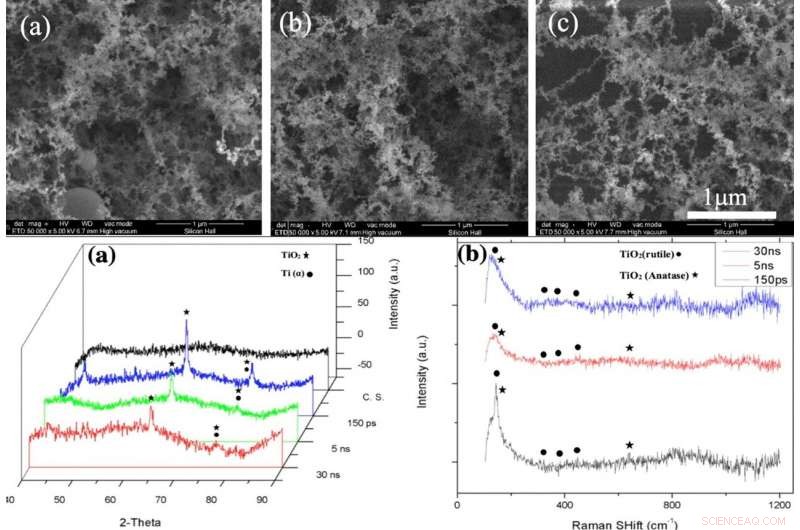 p SUPERIOR:Imagens SEM da camada NFTi (Nanofibrous Titania) com potência =10 W, frequência =600 KHz (a) duração do pulso =150 ps, (b) duração do pulso =5 ns, (c) duração do pulso =30 ns com ampliação de 50000X. INFERIOR:(a) padrão de XRD, (b) Espectro Raman de vidro nu e amostras revestidas por titânia com diferentes durações de pulso (criado por Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-54533-z.
p SUPERIOR:Imagens SEM da camada NFTi (Nanofibrous Titania) com potência =10 W, frequência =600 KHz (a) duração do pulso =150 ps, (b) duração do pulso =5 ns, (c) duração do pulso =30 ns com ampliação de 50000X. INFERIOR:(a) padrão de XRD, (b) Espectro Raman de vidro nu e amostras revestidas por titânia com diferentes durações de pulso (criado por Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-54533-z.
p As equipes de pesquisa já haviam usado várias técnicas para produzir superfícies de material BTE, incluindo sol-gel, hidrotérmico 106, eletrofiação e impressão 3-D; Contudo, selecionar um método ideal continua sendo um desafio. Por exemplo, biomateriais artificiais devem interagir sem esforço com fluidos fisiológicos e assimilar com tecidos duros e moles circundantes para manter a atividade celular para biocompatibilidade superior. Cientistas de materiais e bioengenheiros usaram titânio e suas ligas para implantes ortopédicos, permitindo a osteogênese baseada em nanopartículas de titânio (NP) de células-tronco da polpa dentária e células-tronco derivadas do tecido adiposo. Os métodos de modificação da superfície do laser podem modificar as superfícies do material para melhorar a biocompatibilidade da superfície; onde o método HILIRT já havia mostrado potencial para projetar componentes de laboratório em um chip e outros biomateriais biocompatíveis. Os cientistas podem alterar os parâmetros do laser para manipular as superfícies dos materiais para auxiliar na diferenciação celular.
p No presente trabalho, Beigi et al. investigou os efeitos da duração do pulso do laser em superfícies de materiais usando o método HILIRT e testou o comportamento biológico de biomateriais sintéticos usando a caracterização de materiais e testes biológicos em laboratório. Eles investigaram o contato célula-material em superfícies de materiais usando a expressão gênica, mineralização e estudos de interação de proteínas. Os cientistas desenvolveram uma película fina de titânia nanofibrosa (NFTi) e a embeberam em fluido corporal simulado (SBF) para formar estruturas de camada semelhantes à hidroxiapatita (HA) e identificaram as modificações da superfície do material usando o ângulo de contato com a água (CA), microscopia eletrônica de varredura (SEM), análise de espectroscopia de raios-X dispersiva de energia (EDS), espectroscopias de micro-Raman e difração de raios-X (XRD).
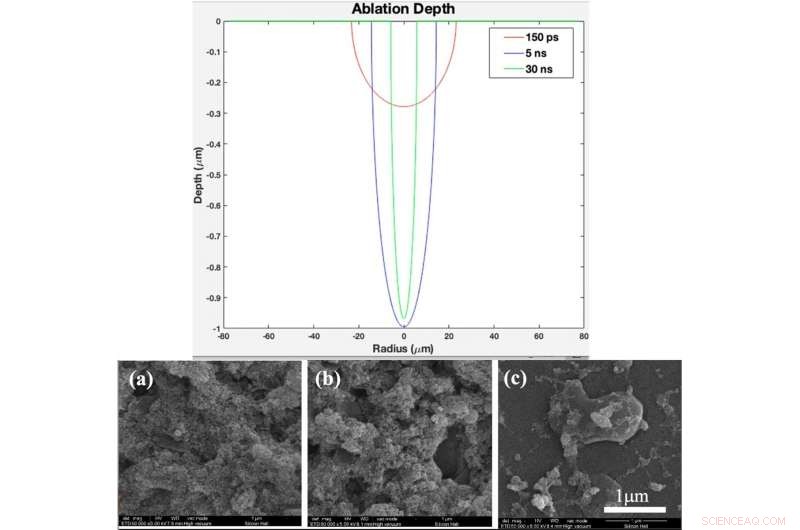 p TOPO:Perfil teórico de profundidade de ablação em função do raio para duração de pulso de 150 ps, 5 ns, e 30 ns (criado no software MATLAB R2015b (9.6.0.1072779) https://www.mathworks.com). INFERIOR:(a) padrão de XRD, (b) Espectro Raman de vidro nu e amostras revestidas por titânia com diferentes durações de pulso após 2 dias de imersão em SBF, (c) padrão de XRD, (d) Raman spectrum of bare glass and samples coated by titania with different pulse duration after 4 days immersion in SBF Fig. 4. (a). XRD pattern, (b) Raman spectrum of bare glass and samples coated by titania with different pulse durations (created by Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédito:Relatórios Científicos, doi:10.1038/s41598-019-54533-z.
p TOPO:Perfil teórico de profundidade de ablação em função do raio para duração de pulso de 150 ps, 5 ns, e 30 ns (criado no software MATLAB R2015b (9.6.0.1072779) https://www.mathworks.com). INFERIOR:(a) padrão de XRD, (b) Espectro Raman de vidro nu e amostras revestidas por titânia com diferentes durações de pulso após 2 dias de imersão em SBF, (c) padrão de XRD, (d) Raman spectrum of bare glass and samples coated by titania with different pulse duration after 4 days immersion in SBF Fig. 4. (a). XRD pattern, (b) Raman spectrum of bare glass and samples coated by titania with different pulse durations (created by Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédito:Relatórios Científicos, doi:10.1038/s41598-019-54533-z.
p They deposited NFTi (nanofibrous titania) structures at different pulse durations to form laser nanofiber coated smooth surfaces and tested the chemical and physical composition of the resulting advanced materials. When they decreased pulse duration, the titanium weight percentage increased, and the scientists observed the temperature of the irradiated zone to be significantly higher for a shorter pulse duration of 150 picoseconds (ps) compared with 5 nanoseconds (ns) and 30 ns. The decreased pulse duration transmitted power to the target in a shorter time, causing the heat affected zone (HAZ) to have a higher temperature, allowing a denser plasma plume to form more NFTi structures on a glass substrate. Decreasing the laser pulse duration created more biocompatible Ti nanofibers with a higher content of HA(hydroxyapatite)-like substance sedimentation on the samples.
p Using phase-contrast microscopy images of fibroblast-like BMSCs on titania-coated glass surfaces, Beigi et al. observed normal cell morphology. They measured water contact angles of droplets of water on the material specimens and conducted cytotoxicity tests with MTS assays on stem cells grown on NFTi coatings. The materials coated with NFTi for 150 ps showed the highest absorbance rate (known as the S1 group) with subsequently high rates of cell viability, cell adhesion and metabolic activity. When the researchers used immunofluorescent staining to observe cell migration, the S1 sample (with NFTi coating for 150 ps) showed higher rates of cell migration. To confirm stem cell (BMSC) differentiation, the scientists investigated osteogenic-related gene expression with RUNX2, collagen I, osteopontin and osteonectin genes, using quantitative qRT-PCR. Entre as amostras, S1 samples indicated significantly higher relative expression for all osteogenic-related genes.
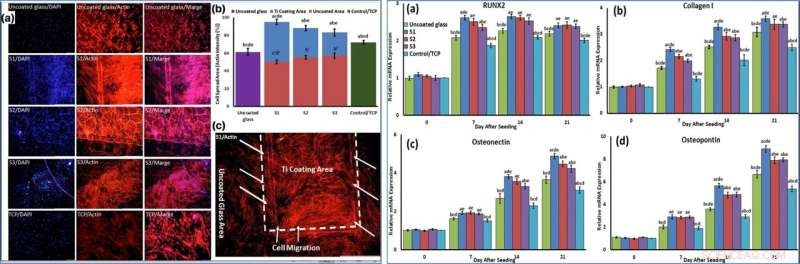 p LEFT:Cells were stained by phalloidin to observe (a, c) and quantify (b) actin filament expansion and migration in all samples after 7 days. The first column in A is DAPI nuclear staining (blue), second column, phalloidin labelled F-actin (red), and third column, overlaid fluorescent image of immunostained cellular components (merge:DAPI/F-actin). The red bars in B indicate the intensity percentage of actin filament on the glass in S1, S2, and S3 samples and the blue bars describe the intensity percentage of actin filament the NFTi coated area. (c) Higher magnification of BMSCs migration from glass area toward Ti coating area in S1. RIGHT:The mRNA relative expression levels of osteogenic genes included Runx2 (a), Collagen I (b), Osteonectin (c), and Osteopontin (d) determined by qRT-PCR for all samples. Crédito:Relatórios Científicos, doi:10.1038/s41598-019-54533-z.
p LEFT:Cells were stained by phalloidin to observe (a, c) and quantify (b) actin filament expansion and migration in all samples after 7 days. The first column in A is DAPI nuclear staining (blue), second column, phalloidin labelled F-actin (red), and third column, overlaid fluorescent image of immunostained cellular components (merge:DAPI/F-actin). The red bars in B indicate the intensity percentage of actin filament on the glass in S1, S2, and S3 samples and the blue bars describe the intensity percentage of actin filament the NFTi coated area. (c) Higher magnification of BMSCs migration from glass area toward Ti coating area in S1. RIGHT:The mRNA relative expression levels of osteogenic genes included Runx2 (a), Collagen I (b), Osteonectin (c), and Osteopontin (d) determined by qRT-PCR for all samples. Crédito:Relatórios Científicos, doi:10.1038/s41598-019-54533-z.
p To confirm mineralization, the scientists used alizarin red followed by soluble Ca nodules color absorbance quantification, to observe high levels of mineralization on all samples on days seven and 14. The team investigated surface protein absorption potential, protein-ion biocomplex formation and biocomplex cell uptake to demonstrate highest levels of protein-ion biocomplex formation on the S1 samples.
p Desta maneira, Mohammad-Hossein Beigi and colleagues used the HILIRT method to achieve high surface bioreactivity, osteogenesis and osseointregration of NFTi-BMSCs. The surface character of the new materials allowed protein and biomolecule interactions to stimulate cell adhesion, mineralization and osteogenesis for faster and more suited osseointegration in vivo and in vitro. The scientists engineered nanofiber mesh-like scaffolds using titanate to allow vascularization, protein attachment, cell proliferation and cell attachment on the substrate. Such microporous surfaces can promote nutrition diffusion, vascularization and blood flow due to improved biomechanical strength. Além disso, the hydrophilic surface property; verified using water contact angle measurements, facilitated cell-ECM adhesion to improve cell binding and vigorous tissue growth.
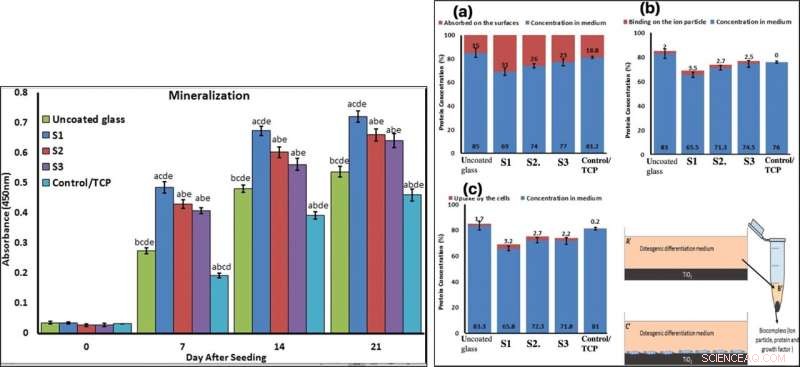 p LEFT:Confirmation of osteogenic differentiation and matrix mineralization of BMSCs by quantifying alizarin red staining. RIGHT:Protein adsorption and biocomplex adsorption/absorption:concentration of protein in osteogenic differentiation medium after 6 hours of immersion (a); concentration of protein in osteogenic differentiation medium after 6 hours of immersion and then centrifuged at 14, 000 rpm for 30 min (b); concentration of protein in osteogenic differentiation medium after 6 hours of immersion with cell culture (c). Crédito:Relatórios Científicos, doi:10.1038/s41598-019-54533-z.
p LEFT:Confirmation of osteogenic differentiation and matrix mineralization of BMSCs by quantifying alizarin red staining. RIGHT:Protein adsorption and biocomplex adsorption/absorption:concentration of protein in osteogenic differentiation medium after 6 hours of immersion (a); concentration of protein in osteogenic differentiation medium after 6 hours of immersion and then centrifuged at 14, 000 rpm for 30 min (b); concentration of protein in osteogenic differentiation medium after 6 hours of immersion with cell culture (c). Crédito:Relatórios Científicos, doi:10.1038/s41598-019-54533-z.
p The S1 sample (NFTi, 150 ps) developed in this work generated the best surface bioreactivity for bone regeneration or bone replacement. Beigi et al. showed the advantages of using titania as an orthopedic implant material and the surface modification strategies implemented in the study improved surface bioreactivity and osteogenesis for assisted bone tissue development. The cost-effective frugal method can provide a metallic nanofiber structure surface to be coated on multiple surfaces for varied biomedical applications. The proposed technique (combining materials engineering with stem cells) will open new doors to engineer advanced biomaterials with enhanced surface bioreactivity for improved biocompatibility in vitro and in vivo. The findings demonstrate beneficial effects of an experimental scaffold in the lab with potential for medical osseointegration as a BTE implant. p © 2019 Science X Network




