Desenvolvendo um modelo de colágeno 3-D para testar a osteogênese magnética assistida in vitro
 p a) Microestrutura de andaimes de colágeno carregados de células examinados sob TEM. As células são circundadas pela matriz de colágeno. As fibrilas de colágeno não mostraram direção preferencial em torno das células sob condições de controle, b) IONPs podem ser identificados na matriz de colágeno ec) próximo às membranas celulares. Após 14 dias, uma nova matriz foi sintetizada pelas células, d) sem SMFs ee) com SMFs. Ambas as condições levaram a uma nova síntese de matriz após 14 dias, sem uma diferença significativa. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p a) Microestrutura de andaimes de colágeno carregados de células examinados sob TEM. As células são circundadas pela matriz de colágeno. As fibrilas de colágeno não mostraram direção preferencial em torno das células sob condições de controle, b) IONPs podem ser identificados na matriz de colágeno ec) próximo às membranas celulares. Após 14 dias, uma nova matriz foi sintetizada pelas células, d) sem SMFs ee) com SMFs. Ambas as condições levaram a uma nova síntese de matriz após 14 dias, sem uma diferença significativa. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p Os mecanismos celulares e moleculares da regeneração óssea baseada na estimulação magnética requerem mais compreensão no momento. Para avaliar o fenômeno no laboratório, um modelo de colágeno nativo tridimensional (3-D) foi recentemente desenvolvido por meio de compressão de plástico para produzir uma célula, estrutura de colágeno densa e mecanicamente forte. Para produzir modelos carregados de células no estudo, Zhiyu Yuan e colegas incorporaram células de osteoblastos (linha celular MG-63) e nanopartículas de óxido de ferro magnético (IONPs) nos géis de colágeno. Usando a impressão 3D, um biorreator magnético foi projetado e fabricado para suportar o crescimento celular sob campos magnéticos estáticos (SMFs). Usando a reação em cadeia da polimerase (PCR), os pesquisadores determinaram o impacto dos SMFs na regulação e expressão de genes relacionados à osteogênese, incluindo o fator de transcrição 2 relacionado ao runt (Runx2), osteonectina (ON) e proteínas morfogenéticas ósseas 2 e 4 (BMP-2 e BMP-4). p Agora publicado em
Relatórios Científicos , os resultados demonstraram que SMFs, IONPs e a matriz de colágeno foram capazes de estimular a proliferação, Produção de fosfatase alcalina e mineralização de osteoblastos. O processo foi habilitado influenciando as interações matriz-célula para influenciar a expressão de Runx2, SOBRE, BMP-2 e BMP-4. O modelo de colágeno ofereceu uma visão para formar progressivamente um novo modelo ósseo mineralizado 3-D e entender a estimulação magnética na osteogênese. Estudos adicionais podem ser conduzidos com o modelo para aplicações em engenharia de tecidos e medicina regenerativa.
p Só no Reino Unido, o número de pacientes que sofrem de fratura óssea tem um impacto econômico substancial na qualidade de vida, conforme evidenciado pelos custos para o Serviço Nacional de Saúde (NHS). Durante a lesão óssea, o processo biológico e mecânico de regeneração fisiológica substitui o osso lesado por osso novo no local da lesão. O processo metabólico é complicado e requer a interação de muitos fatores, incluindo fatores de crescimento e diferenciação, como hormônios, citocinas e componentes extracelulares; entretanto, fatores inadequados ou interrompidos podem levar a uma cicatrização retardada ou prejudicada / não união do osso.
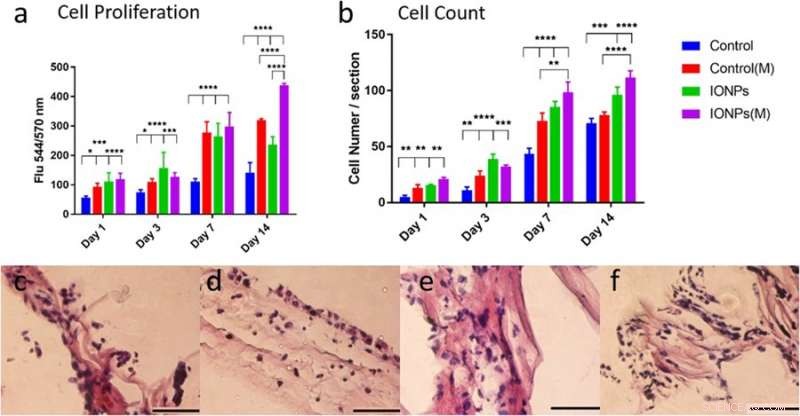 p a) comparação da proliferação de células MG-63 quando cultivadas com / sem a incorporação de IONPs com exposição de SMFs (M) e sem a exposição de SMFs. A proliferação celular pode ser aumentada com SMFs incorporando IONPs, indicando um efeito estimulante, b) Comparar os números de células das linhas de células MG-63 de imagens histológicas com ou sem SMFs. As respostas celulares da linha de células MG-63 cultivadas no arcabouço de colágeno PC também foram examinadas via histologia para condições c) sem SMFs e sem IONPs, d) com SMFs, e) com IONPs ee) combinação de SMFs e IONPs. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p a) comparação da proliferação de células MG-63 quando cultivadas com / sem a incorporação de IONPs com exposição de SMFs (M) e sem a exposição de SMFs. A proliferação celular pode ser aumentada com SMFs incorporando IONPs, indicando um efeito estimulante, b) Comparar os números de células das linhas de células MG-63 de imagens histológicas com ou sem SMFs. As respostas celulares da linha de células MG-63 cultivadas no arcabouço de colágeno PC também foram examinadas via histologia para condições c) sem SMFs e sem IONPs, d) com SMFs, e) com IONPs ee) combinação de SMFs e IONPs. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p No estudo, os autores usaram um romance, modelo biomimético multifuncional de colágeno 3-D para uso como plataforma in vitro para estudar mecanismos de estimulação magnética na osteogênese. Para produzir uma variedade de modelos carregados de células, os pesquisadores introduziram estímulos internos (nanopartículas de óxido de ferro) e externos (campos magnéticos estáticos, SMFs) estímulos no sistema. O material biomimético foi projetado por meio da fabricação de nano e microestruturas usando compressão de plástico, de acordo com um protocolo previamente estabelecido. A fim de avaliar o comportamento biológico dos osteoblastos, incluindo sua proliferação, diferenciação, mineralização, expressão gênica e análise de microestrutura, os cientistas cultivaram o modelo de colágeno em um biorreator magnético por até 42 dias.
p No estudo, A proliferação celular da linha celular de osteoblastos MG-63 foi avaliada usando o ensaio alamarBlue. No dia 14, os pesquisadores observaram uma diferença significativa entre SMFs sozinhos, IONPs isoladamente e em sua combinação na proliferação celular. Técnicas de histologia foram empregadas para examinar as respostas celulares dentro dos andaimes de colágeno e entender o papel dos SMFs e IONPs na proliferação celular. A visualização foi seguida por uma análise quantitativa do número de células, os resultados indicaram que a incorporação de IONPs prolongou o efeito dos SMFs.
p De forma similar, diferenciação celular foi observada com atividades de fosfatase alcalina (ALP) para estruturas de colágeno, com ou sem a incorporação de IONPs. Como antes, quando o efeito de IONPs e SMFs foram combinados, a produção de ALP foi significativamente estimulada em comparação com o tratamento com SMFs sozinhos e IONPs sozinhos. A mineralização celular também foi observada depois disso e quantificada no esqueleto de colágeno semeado com células. Após 42 dias, todas as amostras foram coradas com coloração ARS para indicar mineralização completa. Em contraste, combinar SMFs e IONPs foram incapazes de promover a mineralização.
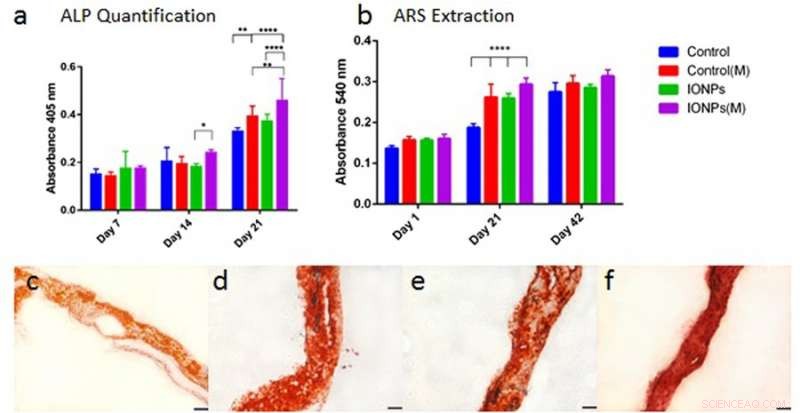 p a) comparar a produção de ALP da linha celular MG-63 quando cultivada em estruturas de colágeno com ou sem a incorporação de IONPs, com exposição a SMFs (M) e sem exposição a SMFs. b) Comparar a mineralização celular pela extração e quantificação da coloração ARS de scaffolds tratados com ou sem exposição a SMFs. Os andaimes de colágeno carregados de células foram integrados com IONPs (100 µg / ml), os resultados foram coletados em 1, 21 e 42 dias de cultura. c) Coloração ARS de andaime de colágeno na ausência de SMFs e IONPs, d) com SMFs, e) com IONPs, ef) com SMFs e IONPs. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p a) comparar a produção de ALP da linha celular MG-63 quando cultivada em estruturas de colágeno com ou sem a incorporação de IONPs, com exposição a SMFs (M) e sem exposição a SMFs. b) Comparar a mineralização celular pela extração e quantificação da coloração ARS de scaffolds tratados com ou sem exposição a SMFs. Os andaimes de colágeno carregados de células foram integrados com IONPs (100 µg / ml), os resultados foram coletados em 1, 21 e 42 dias de cultura. c) Coloração ARS de andaime de colágeno na ausência de SMFs e IONPs, d) com SMFs, e) com IONPs, ef) com SMFs e IONPs. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p Depois disso, os cientistas conduziram estudos para entender as respostas dos andaimes de colágeno semeados por células a SMFs e IONPs em nível molecular. Por esta, os níveis de expressão de Runx2, SOBRE, BMP-2 e BMP-4 foram quantificados usando reação em cadeia da polimerase quantitativa em tempo real (RT-qPCR). Um tratamento de 7 dias de SMFs sozinho não teve um efeito na expressão de Runx2, ao passo que a expressão aumentada foi encontrada quando SMFs foram combinados com IONPs, demonstrando a expressão de Runx2 mediada pela matriz de colágeno durante a osteogênese. No dia 7, o nível de expressão ON nas amostras tratadas com IONPs, SMFs e ambos foram maiores do que no controle em um curto período de tempo. Durante a expressão de BMP-2 e BMP-4, resultados semelhantes foram observados ao longo de 7-14 dias.
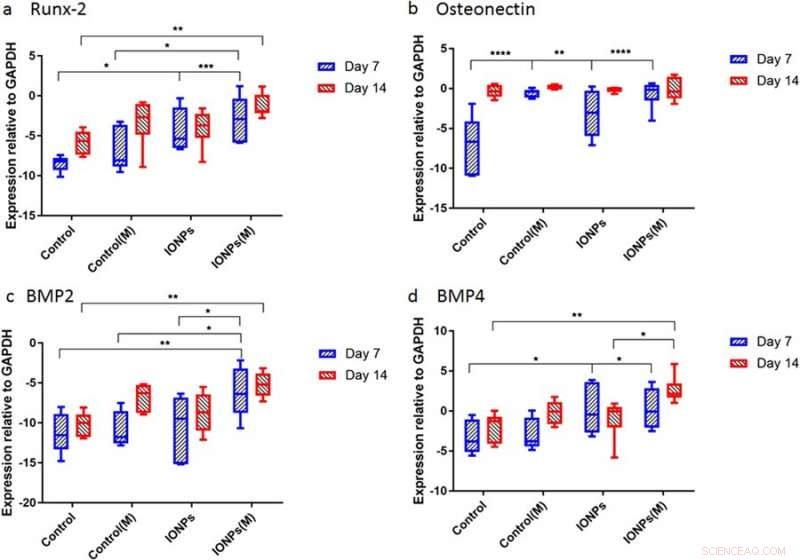 p Expressão gênica para a) Runx2, b) osteonectina (ON), c) BMP-2 e d) BMP-4 normalizado com o controle GAPDH após 7 e 14 dias de cultivo celular. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p Expressão gênica para a) Runx2, b) osteonectina (ON), c) BMP-2 e d) BMP-4 normalizado com o controle GAPDH após 7 e 14 dias de cultivo celular. Crédito: Relatórios Científicos , doi:10.1038 / s41598-018-33455-2.
p O estudo demonstrou principalmente a osteogênese como um processo complexo mediado por ativação e expressão sucessivas de vários genes-chave, incluindo Runx2, SOBRE, BMP-2 e BMP-4. Tipicamente, Runx2 regula positivamente a expressão de genes de proteínas relacionados à matriz óssea para promover a formação óssea in vitro e in vivo. De acordo, o estudo mostrou que a exposição a SMF pode induzir a linha celular a proliferar modulando a expressão precoce de Runx2, para acelerar a osteogênese. Quando IONPs foram incorporados sob SMFs, a expressão do gene da osteonectina (ON) aumentou, ligando as fases de colágeno com o mineral ósseo para iniciar a mineralização do tecido esquelético normal. De forma similar, tanto BMP-2 quanto BMP-4 aumentaram apenas no estudo durante a cultura de células combinadas com SMFs e IONPs.
p Desta maneira, os autores desenvolveram e testaram um modelo biomimético de colágeno 3-D que poderia mineralizar progressivamente para formar um novo modelo ósseo in vitro. O modelo foi incorporado com células de osteoblastos e nanopartículas com capacidade de responder a estímulos magnéticos externos. O modelo biomimético de colágeno foi projetado por compressão de plástico para integrar a linha celular MG-63 e demonstrar resultados reproduzíveis e consistentes combinados com SMFs e IONPs. As interações célula-matriz com sucesso regularam positivamente a expressão de genes-chave relacionados à osteogênese. Os autores pretendem desenvolver o modelo 3-D ainda mais para servir como uma plataforma superior para investigar comportamentos biológicos in vitro com aplicações potenciais em engenharia de tecidos e medicina regenerativa. p © 2018 Science X Network



