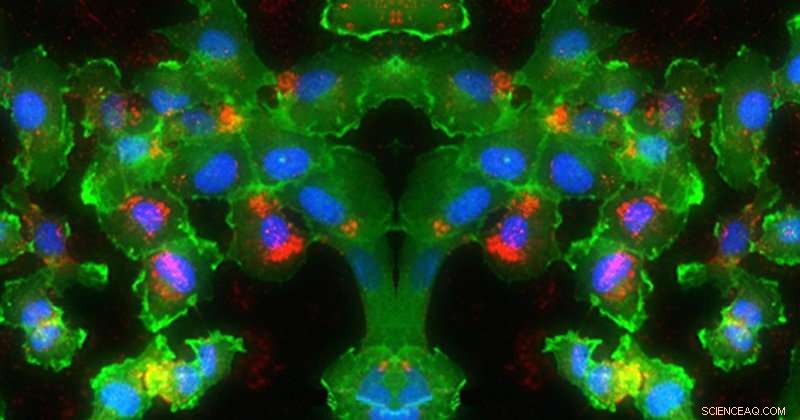
Nesta imagem, O RNA (vermelho) é entregue aos núcleos (azul) das células (verde). Crédito:University of Delaware, Evan Krape, Emily Day e Joy Smoker
Tratamentos de câncer - de radiação a cirurgia e quimioterapia - são projetados para remover ou matar células cancerosas, mas as células saudáveis muitas vezes tornam-se danos colaterais no processo. E se você pudesse usar lasers para localizar a área de tratamento e entregar o medicamento apenas às células cancerosas?
Uma equipe de pesquisa da Universidade de Delaware, liderado por Emily Day, um professor assistente de engenharia biomédica, está lançando as bases para um método para inibir genes promotores de câncer em células cancerosas, deixando as células saudáveis intactas. Em um novo artigo publicado em Nano Letras , a equipe revela insights sem precedentes sobre este método promissor, que envolve o revestimento de nanopartículas com agentes reguladores de genes e, em seguida, expô-los a uma dose de luz laser para liberar esse material.
Como as nanopartículas mantêm os agentes reguladores de genes inativos até que sua liberação seja acionada sob demanda com luz, eles têm um potencial substancial para permitir a terapia do câncer de alta precisão, minimizando o impacto nas células saudáveis não irradiadas. Day e sua equipe testaram seu novo método contra células tumorais cerebrais, usando as nanopartículas para silenciar a expressão da proteína fluorescente verde (GFP) nas células.
Uma nova maneira de combinar lasers e nanopartículas
Como bisturis e suturas, lasers são freqüentemente usados em procedimentos médicos. Os oftalmologistas usam lasers para remodelar córneas em cirurgias oculares que corrigem a visão. Os dermatologistas usam lasers para atenuar cicatrizes na pele. Cardiologistas usam lasers para abrir artérias obstruídas. Oncologistas usam lasers para destruir células cancerosas e tumores.
O Day Lab tem como objetivo combinar lasers com nanopartículas reguladoras de genes responsivos à luz para aniquilar estrategicamente as células cancerosas e minimizar os danos colaterais.
Eles começam com pequenos RNAs interferentes, conhecido como siRNAs, que são moléculas que consistem em fitas complementares de RNA que podem reduzir a expressão de certos genes em células cancerosas. Os siRNAs são revestidos em nanopartículas feitas de sílica e ouro, que medem menos do que a largura de um cabelo humano. Essas partículas protegem os siRNAs até que atinjam a área de tratamento desejada. A questão é:como você os libera exatamente no lugar certo?
"Anteriormente, se as pessoas quisessem entregar RNA com nanopartículas, eles podem revestir as nanopartículas com um polímero ou peptídeo de penetração celular, um agente para facilitar a captação e entrega de células, "Disse Day." O problema é que esses agentes não são específicos. Você acaba obtendo regulação gênica em todas as células, não apenas as células cancerosas que você pretendia atingir para a regulação genética. "
É aí que entra a precisão dos lasers.
"A liberação de siRNA disparada por luz permite silenciar genes apenas onde as partículas e a luz são combinadas, "Dia disse." Já que você escolhe para onde vai a luz, e, portanto, onde o siRNA é liberado, você pode conseguir um silenciamento de gene muito específico em células tumorais, reduzindo o potencial de efeitos fora do alvo. "
Para esses experimentos, Day e sua equipe (liderada pela estudante de graduação do Departamento de Engenharia Biomédica Rachel Riley) expuseram as nanopartículas revestidas de siRNA a ondas de luz contínua ou a pulsos curtos de luz administrados a cada quatrilionésimo de segundo. Ambos os tipos de irradiação desencadearam a liberação de siRNA nas formas de fita dupla e fita simples, o que foi uma surpresa, já que estudos anteriores na literatura científica sugeriram que a irradiação de onda contínua liberaria apenas fitas simples de siRNA (o que significa que as duas fitas complementares do siRNA separadas uma da outra, em vez de todo o duplex se liberando da superfície das nanopartículas).
"Esta é a primeira vez que alguém mostra que você pode obter duplexes de siRNA e fitas simples de RNA para liberar a partir de nanopartículas usando um laser de onda contínua como fonte de excitação, "disse Day." No entanto, nossos estudos também revelam que a luz pulsada é muito mais eficiente na liberação de duplexes siRNA do que a luz de onda contínua. É imperativo que os duplexes sejam liberados principalmente das nanopartículas, porque apenas o siRNA duplexado funcionará dentro das células para silenciar a expressão dos genes-alvo. "
O dia continuou, "Avançar, nossos estudos mostram que a luz pulsada não aquece as células como a luz de onda contínua. Isso é importante, pois muito calor pode fazer com que as células sejam danificadas por mecanismos diferentes da regulação gênica desejada. "
Seu grupo de laboratório está bem equipado para descobrir esses insights sobre o mecanismo de liberação de RNA disparado por luz de nanopartículas, porque eles realizam pesquisas interdisciplinares únicas.

Da esquerda, Margaret Billingsley, Emily Day, e Rachel Riley são mostrados trabalhando em um de seus estudos de pesquisa anteriores, este aqui na detecção do câncer. Crédito:University of Delaware, Evan Krape, Emily Day e Joy Smoker
"Meu laboratório tem muita experiência em entrega de RNA e biologia do câncer, portanto, temos muito mais habilidades de biologia molecular do que um laboratório de nanotecnologia tradicional pode ter, e isso nos permite estudar a função dos nanocarreadores de RNA com detalhes sem precedentes, " ela disse.
O novo insight que a pesquisa de Day lança sobre o uso de luz de onda contínua versus luz pulsada para liberação de siRNA desencadeada a partir de nanopartículas é uma contribuição importante para o campo da distribuição de drogas. Além de demonstrar as diferenças funcionais entre os dois modos de excitação de luz, a equipe também mostrou que o siRNA liberado de nanopartículas após a exposição à luz pulsada reduziu a expressão do gene alvo (proteína fluorescente verde) melhor do que um material disponível comercialmente usado frequentemente para entregar siRNA em células em experimentos de laboratório. Esta foi uma observação emocionante, demonstrando o impacto potencial deste novo sistema.
Este trabalho foi realizado em colaboração com Lars Gundlach no Departamento de Química e Bioquímica e no Departamento de Física e Astronomia da UD, que possui o laser pulsado usado nesses experimentos. Muito mais pesquisas são necessárias antes que isso possa ser traduzido em um tratamento viável para pacientes com câncer.
Qual é o próximo?
"The next step would be to show that we can do this with a more functional and biologically relevant RNA cargo than the siRNA targeting green fluorescent protein that was used in this work, " Day said. "There are a lot of different genes that are known to control cancer growth, so we will deliver RNA that targets genes that we know to be important in tumor progression and see if we are delivering enough to have an impact."
The team is particularly interested in studying the delivery of siRNA targeting beta-catenin, which plays an important role in triple-negative breast cancer, and also the delivery of microRNA (which is similar to siRNA, but can regulate multiple genes simultaneously). Por exemplo, Day's team hopes to deliver miR-34a, which is considered a master regulator of gene expression in cancer.
In addition to Day and Gundlach, the paper's authors include Rachel Riley, a doctoral student in the Department of Biomedical Engineering; Megan Dang, a doctoral student in Department of Biomedical Engineering; Maggie Billingsley, a senior undergraduate student in the Department of Biomedical Engineering; Baxter Abraham, a doctoral student in the Department of Chemistry and Biochemistry.
Riley, who will soon begin work as a postdoctoral associate at the University of Pennsylvania, started graduate school at UD because she wanted to do science that could make a real impact on the medical field. After losing an aunt to cancer, she was especially motivated to put her talents toward research that could someday help patients.
"The Day Lab's idea of incorporating nanoparticles for specific delivery of therapeutic agents was a really unique approach, " ela disse.
Billingsley has done research in the Day Lab since her first year at UD and wrote three peer-reviewed papers based on her work in the group. In 2017, she was the first author on a paper published in PLOS One . Próximo, Billingsley will attend graduate school at the University of Pennsylvania, where she will study immunotherapy. (She and Riley, a duo Day calls a "dream team, " could likely work together in the future.)
"When interviewing with graduate schools, this experience with The Day Lab was the main thing that helped me stand out in interviews and also understand what I wanted out of graduate school, " Billingsley said. "I have had so many opportunities to go down my own path and also work with others on new methods, ideas, and areas of research."
This paper also gave Billingsley a taste of an important aspect of scientific discovery.
"We found some results that conflicted with literature, which was a new experience for me, " she said. "That was more exciting that just confirming what was expected."
Geral, Day and her team are excited to further pursue this technology to reveal its potential as a high precision cancer therapy.