Imagem de super resolução multicor - Um método para monitorar a ligação dinâmica de proteínas em escalas de tempo de subsegundos
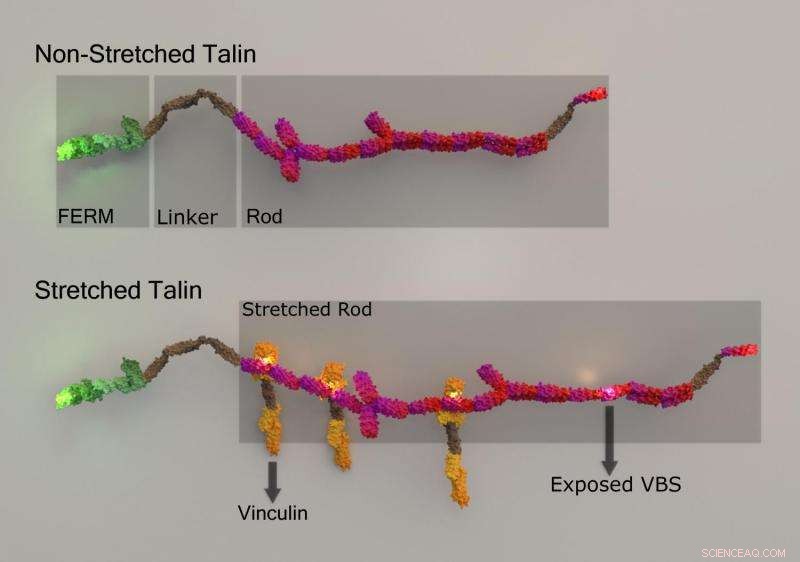 p Alongamento de talina e ligação de vinculina induzida por estiramento. Crédito:Universidade Nacional de Cingapura
p Alongamento de talina e ligação de vinculina induzida por estiramento. Crédito:Universidade Nacional de Cingapura
p Pesquisadores do Instituto de Mecanobiologia (MBI) da Universidade Nacional de Cingapura desenvolveram um novo método, usando microscopia de super-resolução, para determinar o comprimento de proteínas alongadas em células vivas, e monitorar a ligação dinâmica de proteínas, em escalas de tempo abaixo de um segundo. Este estudo foi publicado em
Nano Letras em maio de 2016. p As células são constantemente expostas a forças mecânicas. Esses sinais influenciam a tomada de decisão celular, fornecendo informações que as células precisam para determinar a quantidade de uma determinada proteína a produzir, quando um gene específico deve ser expresso, ou mesmo se uma célula deve se mover ou permanecer onde está. Essas informações são cruciais, por exemplo, na manutenção da saúde, integridade e reparação dos tecidos à medida que envelhecemos. Um exemplo claro de quando as células são expostas a forças é quando caminhamos. Forças de alongamento ou puxão são geradas em nossos músculos, e estes são passados através do músculo para o tecido conjuntivo e osso. Embora essa informação seja gerada em um nível de tecido, ele converge em células únicas dentro desses tecidos, e é detectado e medido pelo subcelular, à base de proteína, máquinas.
p Para medir as forças aplicadas a uma célula, proteínas especializadas podem ser deformadas. Uma maneira comum de isso ocorrer é quando uma proteína é esticada, assim como uma faixa elástica se estica quando sujeita a forças de tração. O alongamento das proteínas pode expor regiões dentro delas que, de outra forma, estariam ocultas. Essas regiões podem servir como locais de encaixe para a fixação de outras proteínas. Isso leva a um efeito bola de neve, em que mais e mais proteínas são capazes de se ligar, e complexos moleculares maiores ou máquinas se formam para mediar uma função celular específica. Este fenômeno foi recentemente explorado pelo Diretor MBI, Professor Michael Sheetz, Pesquisador Sênior Dr. Felix Margadant e estudante de PhD, Sra. Xian Hu (Edna), no trabalho focado na caracterização do alongamento de uma proteína sensora de força conhecida como talin, e estabelecer o efeito que tem na ligação de outra proteína chamada vinculina.
p Embora vários estudos tenham mostrado o alongamento induzido pela força da ligação talin e talin-vinculina in vitro, a visualização simultânea de ambos os eventos e sua correlação com funções celulares específicas não era possível anteriormente em células vivas devido às rápidas escalas de tempo em que ocorrem. Também, realizar imagens multicoloridas de super resolução em células vivas ainda é muito difícil. Para superar esses desafios, O Prof Sheetz e a Sra. Hu desenvolveram um romance, e método de imagem de super-resolução altamente avançado, que lhes permitiu monitorar simultaneamente o comprimento do talin em células vivas, bem como a dinâmica da ligação da vinculina, no nível de uma única molécula e escala de tempo de milissegundos.
p Ao anexar diferentes moléculas fluorescentes (GFP e mCherry), a cada extremidade do talin e um terceiro fluoróforo (Atto655) para vinculina, os pesquisadores puderam monitorar a localização subcelular precisa de cada proteína, e confirme que quando talin estava sendo esticado, vinculina ligada a locais recentemente expostos. Interessantemente, suas descobertas frequentemente revelavam ligações agrupadas, com cinco ou mais moléculas de vinculina ligando-se ao talin em um segundo. Além disso, a ligação das primeiras vinculinas parecia favorecer energicamente a ligação sucessiva de mais moléculas de vinculina. Correlacionando a dinâmica de ligação da vinculina com a quantidade de alongamento de talina, os pesquisadores notaram que a ligação máxima da vinculina ocorreu em uma extremidade específica da talina (a região N-terminal), quando talin foi esticado a aproximadamente 180 nm.
p Entender como o talin e a vinculina respondem às forças de alongamento é crucial para entender como as células respondem às forças em nossos corpos. Nesse caso, ambas as proteínas são encontradas em maquinários moleculares maiores, chamados de aderências focais, que conectam fisicamente o interior de uma célula com o material que a circunda, a matriz extracelular. As adesões focais funcionam principalmente como centros de retransmissão de sinal, e as informações que eles transferem podem induzir o crescimento celular e o movimento celular. Quando este processamento de sinal é interrompido, ou não é regulamentado, surgem estados de doença e a capacidade do corpo de curar feridas, ou manter a integridade do tecido à medida que envelhecemos fica prejudicada.
p Embora seja importante para facilitar esses processos celulares e teciduais mais amplos, a interação talina-vinculina é apenas uma das muitas interações de proteínas para responder à força. Espera-se que este método recém-descrito abra caminho para os pesquisadores dissecar outras interações de proteínas, tanto dentro de aderências focais, e em outras máquinas moleculares, para melhorar nossa compreensão dos muitos processos celulares impulsionados pela força que surgem durante o desenvolvimento e continuam até o envelhecimento.
