Novas ferramentas nanoscópicas para estudar a ligação de ligantes de receptores e quantificar dois locais de ligação de ligantes
 p Um novo método de alta resolução desenvolvido por uma equipe internacional de cientistas, incluindo Robert Tampé e Ralph Wieneke, da Goethe University Frankfurt, agora permite, pela primeira vez, a identificação e quantificação precisa das interações de um receptor com dois ligantes simultaneamente. Crédito:GU
p Um novo método de alta resolução desenvolvido por uma equipe internacional de cientistas, incluindo Robert Tampé e Ralph Wieneke, da Goethe University Frankfurt, agora permite, pela primeira vez, a identificação e quantificação precisa das interações de um receptor com dois ligantes simultaneamente. Crédito:GU
p Os processos de sinalização em organismos são governados por interações extracelulares e intracelulares específicas e envolvem centenas de diferentes receptores funcionalmente altamente versáteis situados nas membranas celulares. Para os cientistas que desejam compreender os processos de sinalização, a situação torna-se mais complexa porque os receptores não apenas são distribuídos de forma desigual e, muitas vezes, são capazes de se ligar a mais de um ligante, mas também pelo mesmo tipo de receptor que é capaz de se ligar fortemente a um ligante. fracamente ou não todos. Novos métodos que permitem quantificações precisas de tais interações complexas são urgentemente necessários. p Um novo método de alta resolução desenvolvido por uma equipe internacional de cientistas, incluindo Robert Tampé e Ralph Wieneke, da Goethe University Frankfurt, agora permite, pela primeira vez, a identificação e quantificação precisa das interações de um receptor com dois ligantes simultaneamente. O novo método foi publicado na última edição da revista.
Nature Communications .
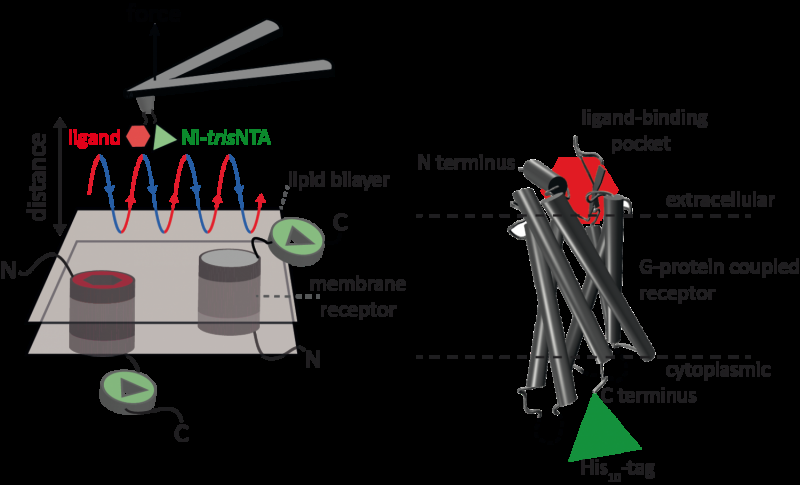
p A microscopia de força atômica (AFM) é uma técnica poderosa para caracterização de superfícies em nanoescala. Faz uso de uma consola de ponta extremamente fina. A microscopia de força atômica baseada em curva de distância de força (AFM baseada em FD) combina imagens de alta resolução e espectroscopia de força de molécula única. Em estudos com amostras biológicas, a ponta AFM se aproxima e se retrai da amostra para cada pixel. Os métodos AFM baseados em FD usam diferentes revestimentos da ponta AFM como uma caixa de ferramentas e esses métodos têm feito um progresso impressionante nos últimos anos. Para a detecção de locais de ligação específicos, AFM baseado em FD requer amarração de um ligante à ponta de AFM. Enquanto contornam complexos de proteínas em uma membrana, tais pontas AFM funcionalizadas podem então medir as interações do ligante com a proteína. Não foi possível obter imagens de receptores de membrana única e, simultaneamente, detectar suas interações com mais de um ligante, mas o novo método superou esse obstáculo.
p Para sua prova de princípio, os cientistas usaram o receptor 1 ativado por protease humana (PAR1), um da grande família de receptores de membrana acoplados à proteína G. GPCRs medeiam a maioria das respostas celulares aos hormônios e neurotransmissores, além de ser responsável pela visão, olfato e sabor. Os GPCRs podem coexistir em diferentes estados funcionais na membrana celular e podem ligar vários ligantes em diferentes forças ou afinidades. O GPCR PAR1 é ativado pela trombina da protease de coagulação que dispara cascatas de sinalização para iniciar as respostas celulares que ajudam a orquestrar a hemostasia, trombose, inflamação e possivelmente também reparação de tecidos. Com a ajuda de seu novo método AFM baseado em FD, PAR1 humano em proteolipossomas pode ser visualizado enquanto detecta simultaneamente interações extracelulares e intracelulares de PAR1 com dois ligantes. A química de superfície e o método nanoscópico desenvolvidos são aplicáveis a uma variedade de sistemas biológicos in vitro e in vivo.
