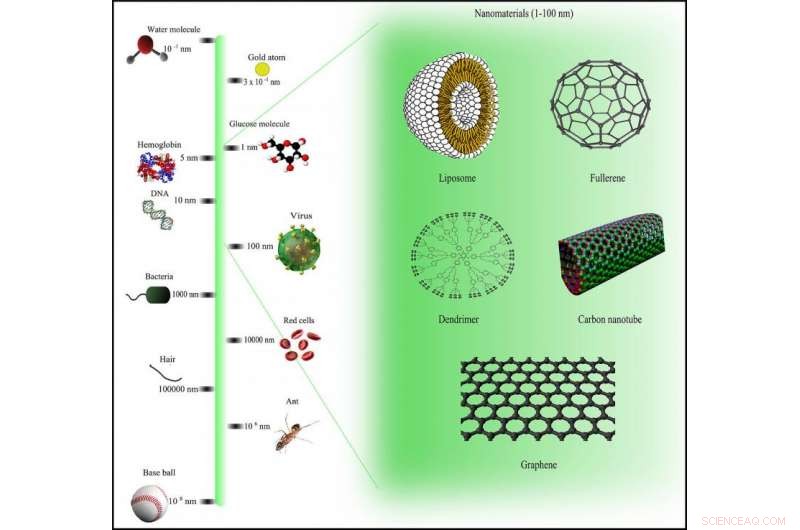
Escala de comparação de nanomateriais via Wikimedia Commons sob a licença CC BY-SA 3.0
Quando você toma uma droga, viaja através de sua corrente sanguínea, dissolvendo e dispersando, e, finalmente, alcançando sua área-alvo designada.
Mas, como o sangue que contém a droga circula por todo o corpo, apenas uma pequena porcentagem da dose inicial chega ao local desejado.
Para medicamentos de venda livre, como paracetamol ou ibuprofeno, com muito poucos efeitos colaterais, isso não importa muito.
Mas quando se trata de drogas contra o câncer, que pode afetar as células saudáveis tanto quanto as células cancerosas, este processo pode causar grandes problemas.
Em parte porque as drogas são diluídas em seu sangue, os pacientes com câncer precisam tomar esses medicamentos em doses particularmente altas - e isso pode causar efeitos colaterais desagradáveis.
Mas a professora Sonia Trigueros, co-diretor do Programa Oxford Martin de Nanotecnologia, está cada vez mais perto de desenvolver um sistema de entrega de drogas em escala nano com o objetivo de alvejar especificamente as células cancerosas.
Trabalhando com uma equipe de químicos, engenheiros e físicos, Trigueros embarcou em uma missão ambiciosa para combater o câncer no nível 'nano' - menos de 100 nanômetros de largura. Para contexto, isso é superminúsculo:um nanômetro é um milésimo de um milésimo de um milímetro.
Ainda há um longo caminho a percorrer, mas Trigueros está fazendo progressos decentes, e recentemente abordou um grande problema de trabalhar em um nível nano. E na conferência Wired Health deste ano - que olhou para o futuro dos cuidados de saúde, bem-estar e genômica - ela nos contou sobre seu progresso recente, e suas visões para o futuro.
No nível nano
Alguns de nós se lembrarão da tabela periódica exibida em nossas aulas de ciências, que nos informava sobre as propriedades de cada elemento. Mas trabalhando em um nível nano, tudo muda, e os elementos se comportam de maneira completamente diferente.
Os elementos têm propriedades diferentes no nível nano do que no nível micro, explicou o Prof Trigueros para a audiência da Wired Health 2015.
Isso representa grandes problemas para os pesquisadores que tentam fazer dispositivos em nanoescala, que pode ser feito de vários materiais diferentes, incluindo ouro, prata e carbono. Todos esses materiais são altamente instáveis no nível nano.
"Depois de fazer as nanoestruturas, você tem apenas alguns minutos a alguns dias para trabalhar, "disse ela. Eles são realmente instáveis, especialmente quando você os coloca na água. "
Isso não é ideal, considerando que nossos corpos são compostos principalmente de água.
Crédito:Professora Sonia Trigueros
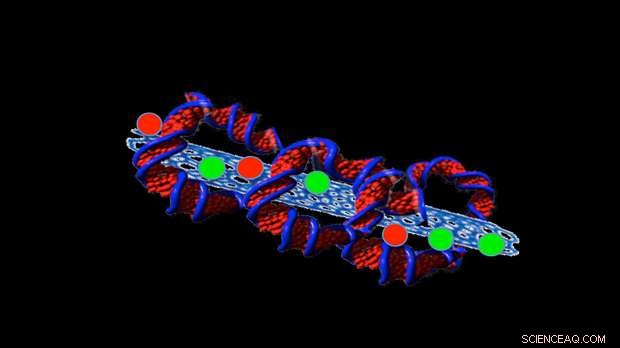
O trabalho recente de Trigueros se concentrou na tentativa de estabilizar pequenos tubos feitos de carbono, chamados nanotubos de carbono, que retêm os medicamentos dentro do tubo para que possam ser administrados às células cancerosas.
Ela agora encontrou uma maneira de mantê-los estáveis por mais de dois anos e em temperaturas de até 42ºC.
Para fazer isso, ela envolve o DNA em torno das estruturas, como uma tortilha envolve os recheios de um burrito.
Embora isso atinja o objetivo de manter as nanoestruturas estáveis dentro do corpo, não adianta muito se o DNA não puder se desdobrar para entregar os medicamentos. Mas, de acordo com Trigueros, ela mostrou isso, uma vez dentro de uma célula, o DNA se desenrola e libera facilmente sua carga útil.
Entrega de medicamento verdadeiramente direcionada
Então, como tudo funciona? Como os medicamentos entram nas células cancerosas? Os nanotubos de Trigueros exploram as diferenças entre as células cancerosas e as células saudáveis - neste caso, diferenças nas membranas que os mantêm unidos.
"As células cancerosas são mais permeáveis do que as células normais, então os nanotubos podem atravessar a membrana celular. E, uma vez dentro, eles desembrulham e entregam drogas, "explicou Trigueros.
Explorar as diferenças em sua permeabilidade é uma maneira de direcionar as células cancerosas, mas Trigueros explica que há mais de uma maneira de criar um sistema de administração de medicamentos verdadeiramente direcionado.
"Podemos anexar o que quisermos no DNA, "ela disse." Então você pode anexar uma proteína que reconhece as células cancerosas ".
Da teoria à realidade
Embora tudo pareça ótimo em teoria, realmente funcionará na realidade?
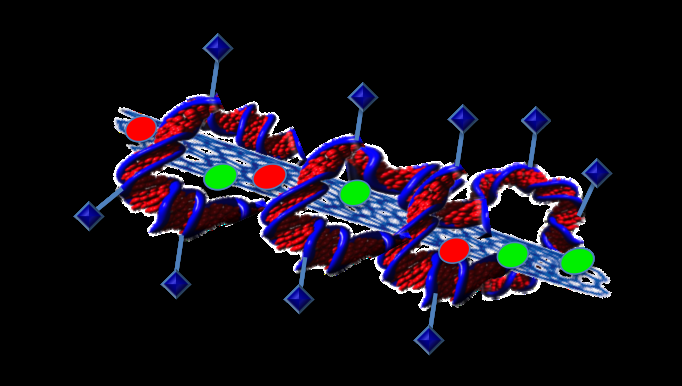
Anexar proteínas ao DNA poderia criar um sistema de entrega de drogas verdadeiramente direcionado. Crédito:Professora Sonia Trigueros
Trigueros agora iniciou testes preliminares em células de câncer de pulmão cultivadas em laboratório, ela nos disse durante uma entrevista. E isso mostrou uma promessa provisória, ela diz, citando dados não publicados sobre sua eficácia em matar essas células no laboratório.
Outros estão cautelosamente otimistas. "Esta é uma perspectiva realmente empolgante, "diz o professor Duncan Graham, especialista em nanotecnologia e consultor do Cancer Research UK.
"Uma preocupação comum com os nanotubos de carbono é a toxicidade, but when coated with DNA this concern could be removed, " he explains, "and it also addresses a fundamental issue, which is that they collect into clusters that become a solid mass and so are unable to leave the body."
Em teoria, once Trigueros's nanotubes have finished their job they are tiny enough (50 nanometres) to be excreted through urine.
This isn't the first time carbon nanotubes have been used in cancer research:a US research team has used them, por exemplo, to target and collect images of tumours in mice. But the combination of drug delivery and cancer-specific targeting is what interests Professor Graham.
"Unlike previous work using carbon nanotubes, this approach is set to target the tumour specifically, potentially meaning fewer side effects and a lower dosage. I look forward to seeing this in animal models which is where the real proof of activity lies, " ele disse.
But he's cautious, stressing that Trigueros's work has not yet been peer-reviewed and published.
Próximos passos
Next Trigueros is aiming towards starting animal trials and, eventualmente, she wants to begin clinical trials in patients – that is if everything goes well.
She hopes to focus on how nanostructures could be used to cross the blood-brain barrier – the brain's highly selective 'bouncer' that only lets certain molecules across. This has been notoriously difficult to get past, making targeting cancers in the brain more difficult.
But there is a still a long way to go and a lot of problems to tackle. In the shorter term, we'll be keeping an eager eye on her drug delivery research, as her ideas continue to develop.