
Pesquisadores da Georgia Tech e da Emory University desenvolveram um novo tipo de pinça biomolecular que pode ajudar os pesquisadores a estudar como as forças mecânicas afetam a atividade bioquímica das células e proteínas. Crédito:Lizhi Cao
Um novo tipo de pinça biomolecular pode ajudar os pesquisadores a estudar como as forças mecânicas afetam a atividade bioquímica das células e proteínas. Os dispositivos - pequenos demais para serem vistos sem um microscópio - usam forças magnéticas e eletroforéticas opostas para esticar com precisão as células e moléculas, mantendo-os em posição de modo que a atividade dos receptores e outras atividades bioquímicas possam ser estudadas.
Matrizes de pinças podem ser combinadas para estudar várias moléculas e células simultaneamente, fornecer uma capacidade de alto rendimento para avaliar os efeitos das forças mecânicas em ampla escala. Detalhes dos dispositivos, que foram desenvolvidos por pesquisadores do Georgia Institute of Technology e da Emory University em Atlanta, foram publicados em 19 de fevereiro, 2014, no jornal Tecnologia .
"Nosso laboratório tem estado muito interessado em interruptores químico-mecânicos na matriz extracelular, mas atualmente temos dificuldade em interrogar esses mecanismos e descobrir como eles funcionam in vivo, "disse Thomas Barker, professor associado do Departamento de Engenharia Biomédica Wallace H. Coulter da Georgia Tech and Emory University. "Este dispositivo pode ajudar biólogos e engenheiros biomédicos a responder a perguntas que não podem ser respondidas agora."
Por exemplo, uma célula que se liga à matriz extracelular pode se ligar a um receptor enquanto a matriz está sendo esticada, e um receptor diferente quando não está sob estresse. Essas diferenças de ligação podem conduzir a mudanças no fenótipo celular e afetar processos como a diferenciação celular. Mas agora são difíceis de estudar.
"Ter um dispositivo como este nos permitirá interrogar quais são os locais de ligação específicos e quais são os gatilhos de ligação específicos, "Barker explicou." Agora, sabemos muito pouco sobre esta área quando se trata de bioquímica de proteínas. "
Os cientistas foram capazes de estudar como células individuais ou proteínas são afetadas por forças mecânicas, mas sua atividade pode variar consideravelmente de célula para célula e entre as moléculas. As novas pinças, que são construídos usando nanolitografia, pode facilitar o estudo de milhares ou mais células e proteínas em agregado. Os pesquisadores estão atualmente testando protótipos de 15 por 15 matrizes que eles acreditam que poderiam ser ampliadas.
"Para mim, não é suficiente puxar e segurar uma única proteína, "disse Barker." Tenho que puxar e segurar dezenas de milhares de proteínas para realmente usar as tecnologias que temos para desenvolver sondas moleculares. "
No centro das pinças estão microesferas de poliestireno de 2,8 mícrons que contêm nanopartículas superparamagnéticas. As minúsculas contas são projetadas para aderir a uma amostra que está sendo estudada. Essa amostra é anexada a uma conta de um lado, e para uma almofada magnética do outro. O ímã atrai a pérola em sua direção, enquanto uma força eletroforética criada pela corrente fluindo através de um padrão de fiação de ouro empurra o cordão para longe.
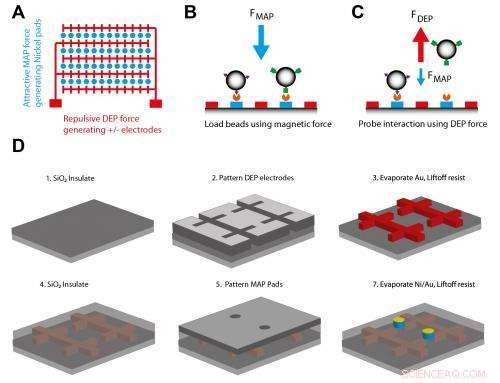
O esquema A mostra o layout do chip, com almofadas circulares de níquel (azul), que pode ser magnetizado por um ímã externo flanqueado por eletrodos de ouro interdigitados (vermelho). O esquema B mostra grânulos paramagnéticos introduzidos na superfície do chip por microfluídicos e carregados nas almofadas magnéticas por manipulação magnética, facilitando a formação de amarras de superfície de grânulo por meio de interações anticorpo-antígeno. O esquemático C mostra as interações sondadas pela aplicação de força nDEP suficiente para deslocar grânulos não especificamente ligados, mas não contas especificamente ligadas. O esquema D mostra como os dispositivos são fabricados. Crédito:Lizhi Cao
"O dispositivo empurra e puxa simultaneamente a mesma partícula, "Barker explicou." Isso nos permite manter a amostra em uma posição muito específica acima do ímã. "
Porque as forças podem ser variadas, as pinças podem ser usadas para estudar estruturas de escalas de tamanho amplamente diferentes, de moléculas de proteína para células - uma diferença de tamanho de aproximadamente mil vezes, observou Wilbur Lam, um professor assistente no Departamento de Coulter. Forças absolutas na faixa de nano-Newton aplicadas pelas duas fontes superam os efeitos muito menores do movimento browniano e da energia térmica, permitindo que a pinça segure as células ou moléculas sem ajuste constante.
"Basicamente, estamos aproveitando a tecnologia de microchip que foi desenvolvida por engenheiros elétricos e mecânicos, "Lam observou." Somos capazes de alavancar esses recursos muito pequenos que nos permitem criar um campo elétrico muito nítido em uma extremidade contra um curto campo magnético oposto. Porque existem duas maneiras de controlá-lo, temos uma resolução precisa e podemos chegar a muitas escalas diferentes. "
Como prova de princípio para o sistema, os pesquisadores demonstraram sua capacidade de distinguir entre a ligação do antígeno a esferas magnéticas carregadas revestidas com diferentes anticorpos. Quando uma força ascendente suficiente é aplicada, grânulos revestidos com anticorpo não específico são deslocados da superfície do dispositivo revestido com antígeno, enquanto os grânulos revestidos com o anticorpo específico são mais fortemente atraídos para a superfície e retidos nela.
Barker e Lam começaram a trabalhar juntos nas pinças há três anos, quando perceberam que tinham interesses semelhantes em estudar os efeitos da ação mecânica em diferentes sistemas biológicos.
"Não devemos nos surpreender que a biologia possa ser ditada por parâmetros físicos, "Lam explicou." Tudo tem que obedecer às leis da física, e a mecânica chega ao cerne disso. "
O interesse de Lam está na escala celular, especificamente nas células sanguíneas.
"As células sanguíneas também respondem de forma diferente, biologicamente, quando você os aperta e quando você os estica, "disse ele." Por exemplo, aprendemos que a mecânica tem muito a ver com a aterosclerose, mas os sistemas que temos atualmente para estudar este mecanismo só podem olhar para eventos de uma única célula. Se você puder olhar para muitas células ao mesmo tempo, você obtém uma visão estatística muito melhor do que está acontecendo. "
Os interesses de Barker, Contudo, estão no nível molecular.
"Estamos principalmente interessados em desenvolver anticorpos que sejam capazes de distinguir diferentes conformações de proteínas mediadas por força, "ele explicou." Temos uma proteína específica na qual estamos interessados, mas essa técnica poderia ser aplicada a qualquer proteína suspeita de ter essas mudanças ativadas por força em sua atividade bioquímica. "
Enquanto as pinças atendem às necessidades experimentais específicas de Lam e Barker, os pesquisadores esperam encontrar outras aplicações. As pinças foram desenvolvidas em colaboração com o estudante de graduação Lizhi Cao e o colega de pós-doutorado Zhengchun Peng.
"Devido à escala que podemos examinar - tanto molecular quanto celular - acho que isso terá muitas aplicações tanto na engenharia molecular de proteínas quanto na biotecnologia, "Disse Lam." Esta poderia ser uma forma útil para as pessoas rastrearem moléculas relevantes, porque atualmente não existem boas maneiras de fazer isso. "
Além dos sistemas biológicos, o dispositivo pode ser usado no desenvolvimento de materiais, microeletrônica e até mesmo detecção.
"Esta capacidade de detectar eventos de ligação e desacoplamento discretos entre as espécies moleculares é de grande interesse agora, "Barker acrescentou." As aplicações de biossensores surgem disso naturalmente. "