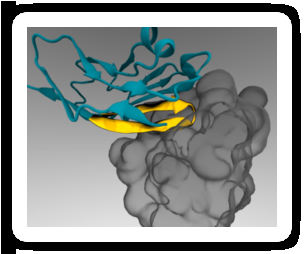
Um "passaporte" de peptídeo mínimo (amarelo) pode ser anexado a nanopartículas terapêuticas de modo que se ligue a um receptor de célula imune (cinza) e evite o engolfamento. Crédito:Diego Pantano
Os cientistas descobriram uma maneira de infiltrar nanopartículas contendo drogas de combate a tumores através das células do sistema imunológico, que normalmente envolveria as partículas, impedindo-os de alcançar seu alvo. A técnica aproveita o fato de que todas as células do corpo humano exibem uma proteína em suas membranas que funciona como um 'passaporte' específico para instruir as células do sistema imunológico a não atacá-las. Ao anexar um pequeno pedaço desta proteína às nanopartículas, os cientistas foram capazes de enganar as células do sistema imunológico em camundongos para que reconhecessem as partículas como "próprias" em vez de estranhas, aumentando assim a quantidade de medicamento entregue aos tumores.
Nanotecnologia do câncer
As abordagens atuais para a quimioterapia deixam os pacientes com efeitos colaterais graves, porque os medicamentos anticâncer, destinados a destruir tumores, matam inadvertidamente as células saudáveis do corpo. Mas os cientistas desenvolveram recentemente nanopartículas que podem transportar medicamentos tóxicos diretamente para os tumores, poupando o tecido saudável. Por causa de seu tamanho pequeno, as nanopartículas escapam de vasos sanguíneos com vazamento característicos de tumores e se acumulam no tecido canceroso. As células tumorais absorvem as partículas que liberam seu conteúdo tóxico uma vez dentro. Esse sistema de administração localizada permite que os médicos dêem aos pacientes doses mais altas de medicamentos do que normalmente seriam toleradas.
Tentativas anteriores foram feitas para evitar o ataque do sistema imunológico revestindo densamente as nanopartículas com "escovas" de polietilenoglicol (PEG) que bloqueiam fisicamente a adesão de proteínas que normalmente se depositam em corpos estranhos para atrair macrófagos. Embora essas escovas retardem o início da resposta imunológica, eles não o impedem.
A inspiração para o trabalho inovador de Discher remonta a treze anos, quando um grupo de pesquisadores mostrou com camundongos geneticamente modificados que uma proteína chamada CD47 - que é encontrada nas membranas celulares de quase todos os mamíferos - interage com um receptor em macrófagos chamado SIRPa, e, ao fazer isso, sinaliza que a célula é nativa e não deve ser destruída. As descobertas giram em torno da exclusão do CD47 do mouse e levantaram muitas questões, incluindo como esses ratos sobrevivem e se houve relevância para os humanos.
Discher, que estava desenvolvendo nanopartículas que se automontam em várias formas no momento da descoberta, perceberam que o mecanismo CD47-SIRPa para auto-reconhecimento poderia, em princípio, ser explorado para ajudar as nanopartículas a passarem furtivamente pelo sistema imunológico. Mas também estava claro que versões humanas de proteínas purificadas precisavam ser estudadas para qualquer tradução para humanos.
Em 2008, O laboratório de Discher demonstrou que o CD47 humano age de forma semelhante ao CD47 de camundongo como um "marcador de si mesmo" por meio da sinalização através do receptor SIRPa. Pouco depois, um grupo de pesquisadores elucidou a estrutura combinada de CD47 e SIRPa humanos em detalhes atômicos. O laboratório de Discher usou essas informações para conduzir simulações de computador e identificar a menor parte do CD47 que ainda poderia se ligar ao SIRPa. O resultado foi um peptídeo curto que o laboratório de Discher sintetizou quimicamente e anexou a nanopartículas padrão.
"Reduzir o CD47 a um peptídeo essencial foi uma etapa fundamental, "disse Discher." O sequenciamento de milhares de genomas humanos em todo o mundo revelou recentemente muitas variações nas sequências de CD47 e SIRPa. Precisávamos criar um peptídeo 'universal' que pudesse ligar SIRPa e funcionar em todos os humanos, apesar dessas diferenças. "
Nanopartículas furtivas evitam a resposta imunológica
Para testar se seu peptídeo poderia ajudar as nanopartículas a escapar do sistema imunológico, A equipe de Discher injetou nanopartículas ligadas a peptídeos e nanopartículas sem CD47 em camundongos. Ambos os tipos de nanopartículas continham um corante fluorescente que permitiu aos cientistas rastrear as partículas. Em artigo publicado em 22 de fevereiro, 2013 em Ciência , os pesquisadores relataram que em apenas trinta minutos após a injeção das partículas, o sangue dos camundongos continha quatro vezes mais nanopartículas contendo peptídeo CD47 do que partículas sem o peptídeo, sugerindo que as partículas ligadas ao CD47 estavam sendo vistas pelos macrófagos como sendo semelhantes às células que pertenciam ao corpo.
Encorajado por esses resultados iniciais, a próxima equipe preencheu suas nanopartículas ligadas a CD47, bem como nanopartículas revestidas com PEG sem CD47, com a droga anticâncer paclitaxel mais um anticorpo direcionado a tumor. A equipe injetou separadamente os dois tipos de nanopartículas, bem como o cremóforo - o portador padrão do paclitaxel - em camundongos com tumores semelhantes aos humanos. Depois de apenas um dia, os tumores em camundongos injetados com nanopartículas ligadas a CD47 eram 70% do tamanho daqueles injetados com nanopartículas revestidas com PEG. Adicionalmente, Nanopartículas ligadas a CD47 eram tão boas ou melhores na redução de tumores quanto o Cremóforo, sem causar quaisquer efeitos colaterais. A equipe passou a documentar as mudanças moleculares que ocorrem dentro dos macrófagos quando o CD47 inibe o engolfamento, sugerindo que medicamentos adicionais podem ser usados para inibir a depuração.
"Os ensaios clínicos usando nanopartículas para fornecer drogas anticâncer estão em andamento, mas a eliminação pelo sistema imunológico continua sendo um obstáculo significativo, "disse Karen Peterson, Ph.D., Conselheiro Sênior de Programas Extramuros no NIBIB. "O trabalho de Discher é uma abordagem elegante, o que poderia permitir que outras nanoterapêuticas fossem eficazes em ensaios clínicos, fornecendo uma "autenticação" molecular que o corpo não reconhece como estranha. "
Peterson também observou a combinação de bioengenharia e modelagem de computador que foi usada para gerar o peptídeo; A capacidade de Discher de testar a função de peptídeos de tamanhos diferentes via simulação de computador primeiro, e, em seguida, produzir um peptídeo feito pelo homem com base nessas simulações permitiu-lhe eliminar parte do jogo de adivinhação, economizando tempo e dinheiro no longo prazo.
Aplicações futuras
Discher especula que seu peptídeo CD47 poderia ser usado de forma semelhante para prevenir a eliminação imune de vírus usados para entregar genes para tratamento de terapia genética ou para aumentar a biocompatibilidade e durabilidade de objetos estranhos maiores, como marca-passos e implantes, cujas partes podem degradar com o tempo devido a ataques do sistema imunológico.