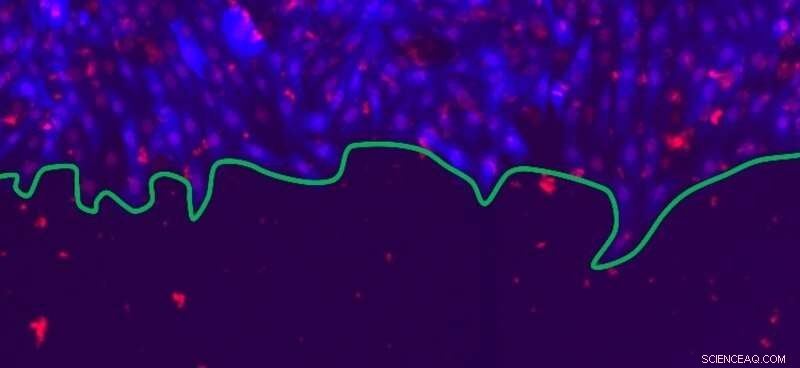
Imagem de microscopia fluorescente de uma frente de célula em proliferação, cuja borda é indicada em verde. As células epiteliais de rato, com citoplasma (azul) e núcleos (vermelho), formar uma cultura bidimensional que pode ser usada para modelar a cicatrização de feridas. Crédito:© Guillaume Rapin, UNIGE
Na física dos materiais, a compreensão de como os sistemas interagem nas interfaces que os separam é de interesse central. Mas os modelos físicos podem esclarecer conceitos semelhantes em sistemas vivos, como células? Físicos da Universidade de Genebra (UNIGE), em colaboração com a Universidade de Zurique (UZH), usou a estrutura de sistemas elásticos desordenados para estudar o processo de cicatrização de feridas - a proliferação de frentes celulares que eventualmente se unem para fechar uma lesão. Seu estudo identificou as escalas das interações dominantes entre as células que determinam esse processo. Os resultados, publicado no jornal Relatórios Científicos , permitirá uma melhor análise do comportamento da frente da célula, em termos de cicatrização de feridas e desenvolvimento de tumor. No futuro, esta abordagem pode oferecer diagnósticos personalizados para classificar os cânceres e direcionar melhor seu tratamento, e identificar novos alvos farmacológicos para o transplante.
Ao focar nas propriedades macroscópicas de grandes conjuntos de dados, a física estatística torna possível extrair uma visão geral do comportamento do sistema independente de seu caráter microscópico específico. Aplicado a elementos biológicos, como as frentes de células ao redor de uma ferida, esta abordagem torna possível identificar as várias interações que desempenham um papel definidor durante o crescimento do tecido, diferenciação, e cura, mas acima de tudo para destacar sua hierarquia nas diferentes escalas observadas. Patrycja Paruch, professor do Departamento de Física da Matéria Quântica da Faculdade de Ciências da UNIGE, explica:"Para invasão de tumor de câncer, ou no caso de uma ferida, a proliferação da frente celular é crucial, mas a velocidade e morfologia da frente são altamente variáveis. Contudo, acreditamos que apenas algumas interações dominantes durante este processo definirão a dinâmica e a forma - suave ou áspera, por exemplo - da borda da colônia de células. Observações experimentais em várias escalas de comprimento para extrair comportamentos gerais podem nos permitir identificar essas interações em tecido saudável e diagnosticar em que nível as mudanças patológicas podem ocorrer, para ajudar a combatê-los. É aqui que entra a física estatística. "
As muitas escalas de cicatrização de feridas
Neste estudo multidisciplinar, os físicos da UNIGE colaboraram com a equipe do professor Steven Brown, do UZH. Usando células epiteliais de rato, eles estabeleceram colônias planas (2D) nas quais as células crescem em torno de uma inserção de silicone, subsequentemente removido para imitar uma lesão aberta. As frentes celulares então se proliferam para preencher a abertura e curar o tecido. “Nós reproduzimos cinco cenários possíveis 'limitando' as células de diferentes maneiras, para ver o impacto que isso tem na cicatrização de feridas, ou seja, na velocidade e aspereza da frente da célula, "explica Guillaume Rapin, pesquisador da equipe de Patrycja Paruch. A ideia é ver o que acontece no tecido saudável normal, ou quando processos como divisão celular e comunicação entre células vizinhas são inibidos, quando a mobilidade celular é reduzida ou quando as células são permanentemente estimuladas farmacologicamente. "Tiramos cerca de 300 imagens a cada quatro horas por cerca de 80 horas, o que nos permitiu observar as frentes celulares em proliferação em escalas muito diferentes, "continua Guillaume Rapin." Ao aplicar técnicas computacionais de alto desempenho, fomos capazes de comparar nossas observações experimentais com os resultados de simulações numéricas, "acrescenta Nirvana Caballero, outro pesquisador da equipe de Patrycja Paruch.
Diminuindo o zoom para um efeito maior
Os cientistas observaram dois regimes de rugosidade distintos:em menos de 15 micrômetros, abaixo do tamanho de uma única célula, e entre 80 e 200 micrômetros, quando várias células estão envolvidas. "Analisamos como o expoente de rugosidade evolui ao longo do tempo para atingir seu equilíbrio dinâmico natural, dependendo das condições farmacoquímicas que impusemos às células, e como essa rugosidade aumenta dependendo da escala para a qual olhamos, "enfatiza o Nirvana Caballero." Em um sistema com uma única interação dominante, esperamos ver o mesmo expoente de rugosidade em todas as escalas. Aqui, vemos uma alteração da aspereza se olharmos para a escala de uma célula ou de 10 células. "
As equipes de Genebra e Zurique revelaram apenas pequenas variações no expoente de rugosidade abaixo de 15 micrômetros, quaisquer que sejam as condições impostas nas frentes de células. Por outro lado, eles descobriram que entre 80 e 150 micrômetros, a rugosidade é alterada por todos os inibidores farmacológicos, reduzindo significativamente o expoente de rugosidade. Além disso, eles observaram que a velocidade de proliferação variou muito entre as diferentes condições farmacoquímicas, desacelerando quando a divisão celular e a motilidade foram inibidas, e acelerando quando as células foram estimuladas. "Mais surpreendentemente, a velocidade de proliferação mais rápida foi alcançada quando a comunicação de junção de lacuna entre as células foi bloqueada, ", diz Guillaume Rapin. Esta observação sugere que essa comunicação pode ser direcionada em futuras terapias, seja para promover a cura de queimaduras ou feridas, ou para retardar a invasão do tumor cancerígeno.
Esses resultados mostram que as interações em média escala desempenham um papel crucial na determinação da proliferação saudável de uma frente celular. "Agora sabemos em que escala os biólogos devem procurar o comportamento problemático das frentes celulares, que pode levar ao desenvolvimento de tumores, ", diz Nirvana Caballero. Agora os cientistas poderão se concentrar nessas escalas de comprimento chave para sondar as frentes de células tumorais, e comparar diretamente suas interações patológicas com as de células saudáveis.